
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是
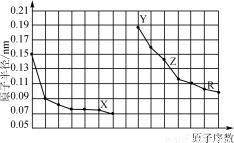
A.X、R的最高化合价相同
B.简单离子的半径:X>Y>Z
C.Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应
D.电解熔融的X与Z构成的化合物可以得到单质Z
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Mg2+、Fe2+、A13+和SO42—五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子 有
有
A.4种 B.3种 C.2种 D.1种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:选择题
下列各组微粒在指定溶液中一定能大量共存的是
A.石蕊变红色的溶液:Na+ .Mg2+ Cl—、SO2-4
B.能溶解氧化铝粉末的溶液中:K+、N0-3、Cl-、NH4+
C.滴加苯酚溶液显紫色的溶液:NH4,K+、Cl-、H2S
D.由水电离出的c ( H+)=10-12mol.L-1的溶液:Na+、K+、.NO3-、C6H5O—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:简答题
(14分)综合利用CO2、CO对构建低碳社会有重要意义。
(1)Li4SiO4可用于富集得到高浓度CO2。原理是:在500℃,低浓度CO2与Li4SiO4接触后生成两种锂盐;平衡后加热至700℃,反应逆向进行,放出高浓度CO2,Li4SiO4再生。700℃时反应的化学方程式为____________。
(2)固体氧化物电解池(SOEC)用于高温共电解CO2/H2O,既可高效制备合成气(CO+H2),又可实现CO2的减排,其工作原理如图。
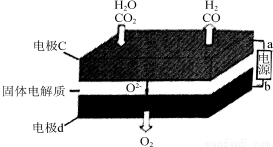
①b为电源的________(填“正极”或“负极”)。
②写出电极c发生的电极反应式:________、________________。
(3)电解生成的合成气在催化剂作用下发生如下反应:CO(g)+2H2(g) CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数值为_______,此时向容器中再通入0.35 mol CO气体,则此平衡将________(填“向正反应方向”“不”或“向逆反应方向”)移动。
(4)已知: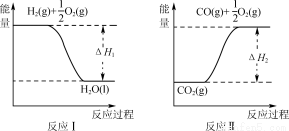
若甲醇的燃烧热为ΔH3,试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) CH3OH(l)的ΔH,则ΔH=_____。
CH3OH(l)的ΔH,则ΔH=_____。
(5)利用太阳能和缺铁氧化物[如Fe0.9O]可将廉价CO2热解为碳和氧气,实现CO2再资源化,转化过程如图所示,若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
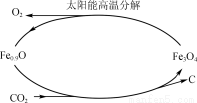
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.粗锌与稀硫酸反应比纯锌快,说明粗锌中含有更活泼的金属
B.新制氯水显酸性,滴加少量紫色石蕊溶液,溶液始终呈红色
C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA-的电离程度大于其水解程度
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的ΔH<0,ΔS>0
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在水溶液中能大量共存的是
A.NH4+、Ag+、CO32—、SO42— B.Fe2+、H+、NO3—、Cl-
C.Al3+、NH4+、HCO3—、Cl- D.K+、Na+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:计算题
(12分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:

(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是 。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式: 。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值(写出计算过程)。涉及反应如下(均未配平):
NiOOH+Fe2++H+—Ni2++Fe3++H2O Fe2++MnO4-+H+—Fe3++Mn2++H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17 %。下列说法不正确的是
A.CO2属于酸性氧化物
B.CO2是导致酸雨发生的主要原因
C.可用Na2CO3溶液捕捉(吸收)CO2
D.使用氢能源替代化石燃料可减少CO2排放
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:简答题
【化学—选修3:物质结构与性质】(15分)中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物。回答下列问题:
(1)氮、磷、钾三种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(2)叠氮酸(HN3)是一种弱酸,可电离出H+和N3一。
①N3一的立体构型是 形:与N3一互为等电子体的一种分子是 (填分子式)。
②叠氮化物能与Co 3十形成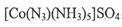 ,该配合物中心离子的配位数为 ;
,该配合物中心离子的配位数为 ;
基态钻原子的价层电子排布式为
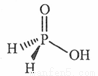
(3)磷能形成多种含氧酸,某资料认为次磷酸的结构如图。按此结构,P原子采用的杂化方式为 ,次磷酸分子中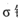 键与
键与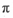 键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
键数目之比为 ,次磷酸属于 酸(填“强”或“弱,’),lmol次磷酸最多能与 mo1NaOH发生中和反应。
(4)己知钾的一种化合物KIC12受热可分解,倾向于生成晶格能更大的物质。则下列化学反应更易发生的是

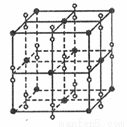
(5)钾在氧气中燃烧时得到多种氧化物,其中一种是面心立方结构,晶胞结构如下图所示。若该氧化物的密度是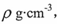 ,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
,则晶胞中最近的两个钾离子间的距离为 pm(只要求列算式,不必计算出数值,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com