
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
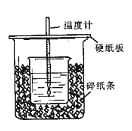
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
【答案】(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)偏小
(4)不相等,相等,因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关 (5)偏小;
【解析】
考查中和热的测定、误差分析及反应热的有关计算等。
(1)由于在实验过程中,需要搅拌,所以还缺少环形玻璃棒。
(2)由于该实验要尽可能的减少热量的损失,所以烧杯间填满碎纸条的作用是保温、隔热,减少实验过程中热量的损失的。
(3)大烧杯上如不盖硬纸板,则会导致热量的损失,所以所得中和热数值偏低。
(4)如果改变酸或碱的用量,则反应中生成的水的物质的量是不变的,因此反应中放出的热量是变化的。但由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,与酸碱的用量无关,因此所求中和热数值是不变的。
(5)由于氨水是弱碱,在溶液中存在电离平衡,而电离是吸热的,所以测得的中和热数值会偏小。


科目:高中化学 来源: 题型:
【题目】FeCl3是一种常用的净水剂,化学研究两小组甲、乙分别用如图装置制备无水FeCl3并证明产品中没有FeCl2,已知无水FeCl3在空气中易潮解,加热易升华。
I.小组甲拟用下图实验装置来制备无水FeCl3。(每个虚线框表示一个单元装置)

(1)请用文字描述方法改正以上装管的错误_____________。
II.小组乙用下列装置组装制备无水FeCl3的装置:

(2)A中发生反应的离子方程式为_______________。
(3)装置接口的连接顺序为__________(用a、b、c……i表示):反应开始前应先点燃____处酒精灯(填“A”或“C”)。
(4)装置B的作用_________________。
(5)如果拆去E和F装置,可能的后果是___________。
(6)证明产品中没有FeCl2的操作____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氨的叙述中,错误的是( )
A.氨易液化,因此可用作制冷剂
B.氨易溶解于水,因此可用来做喷泉实验
C.氨极易溶解于水,因此氨水比较稳定(很难分解)
D.氨溶解于水显弱碱性,因此可使酚酞试剂变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
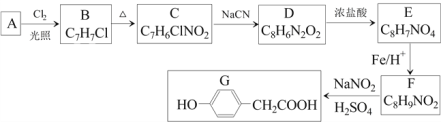
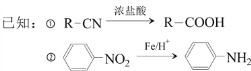
【题目】对羟基苯乙酸是合成药物的中间体,其制备路线如下(A为芳香烃):
回答下列问题:
(1)A的名称是______________。
(2)B→C的反应试剂是_______ ,反应类型是_______;E→F的反应类型是_______。
(3)C→D反应的化学方程式为________________。
(4)E中含氧官能团的名称为______。
(5)1molG与足量NaOH溶液反应,可以消耗_____molNaOH。
(6)H是G的同系物,满足下列条件的H的同分异构体有_______种(不考虑立体异构)。
① H相对分子质量比G大14 ② 苯环上含两个取代基
其中核磁共振氢谱为六组峰,峰面积之比为1:2:2:2:2:1的结构简式为_____________。
(7)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能:kJ/mol | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g)![]() 2N(g)放出能量
2N(g)放出能量
B.过程N(g)+3F(g)![]() NF3(g)放出能量
NF3(g)放出能量
C.反应N2(g)+3F2(g)![]() 2NF3(g)的ΔH>0
2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍能可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可知( )
A. NH4HCO3和盐酸的反应是放热反应
B. 该反应中,热能转化为产物内部的能量
C. 反应物的总能量高于生成物的总能量
D. 反应物中化学键断裂吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)根据物质结构有关性质和特点,回答以下问题:
(1)过渡元素Co 基态原子价电子轨道表达式为_______________________________。第四电离能I4 (Co) < I4 (Fe) ,其原因是__________________________________________。
(2)磷的氯化物有两种:PCl3和PCl5 ,PCl3中磷原子的杂化类型为__________,PCl3的立体构型为__________,其中PCl3的沸点________(填“大于”或“小于”)PCl5,原因是__________。
(3)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图所示,该分子中存在的化学键为___________(填选项字母)
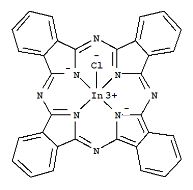
a.σ键 b.π键 c.离子键 d.配位键
(4)氯有多种含氧酸,其电离平衡常数如下:
化学式 | HClO4 | HClO3 | HClO2 | HClO |
Ka | 1×1010 | 1×10 | 1×102 | 4×108 |
从物质结构的角度解释以上含氧酸 Ka 依次减小的原因________________________。
(5)钴的一种化合物的晶胞结构如下图所示:
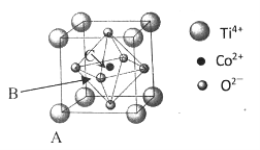
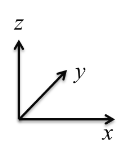
①已知A点的原子坐标参数为(0,0,0),C 点为(1/2,1/2,1/2),则B点的原子坐标参数为___________。
②已知晶胞参数 a = 0.5485 nm,则该晶体的密度为_______________g/cm3。(列出计算表达式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)④、⑤、⑥的原子半径由大到小的顺序为_____________________(填化学式)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:_______。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的溶液易被催化分解,写出其化学方程式____。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_____________,N→⑥的单质的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com