
| A. | 低碳生活注重节能减排,减少温室气体的排放 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量 |
分析 A.低碳生活可以减少二氧化碳的排放;
B.塑料不能降解,导致白色污染;
C.计算机芯片的材料是晶体硅;
D.大气中细颗粒物属于空气的污染源之一.
解答 解:A.低碳生活可以减少二氧化碳的排放,二氧化碳会引起温室效应,所以低碳生活注重节能减排,减少温室气体的排放,故A正确;
B.塑料不能降解,导致白色污染,则推广使用可降解塑料及布质购物袋,以减少“白色污染”,故B正确;
C.沙子的成分是二氧化硅,利用沙子为原料可以制备高纯度的单质硅,计算机芯片的材料是硅单质,故C错误;
D.大气中细颗粒物属于空气的污染源之一,要追根溯源,采取措施,来改善空气质量,与“绿色思想”相符合,故D正确.
故选C.
点评 本题考查环境保护及绿色化学,把握物质的性质、化学与生活的联系、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ①和③ | C. | ②和③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
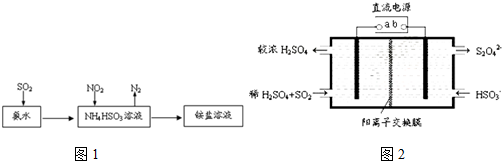
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
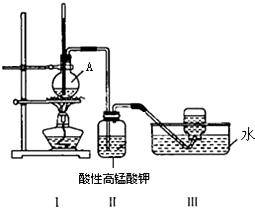 某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:
某学习小组在实验室里用乙醇与浓硫酸混合加热制乙烯,并进行有关乙烯性质的探究.装置如图.请帮助回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
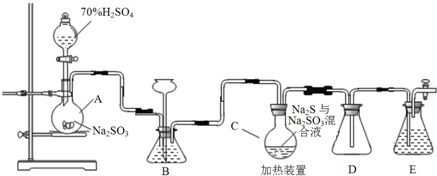
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com