
| A. | 分散质粒子大小介于10-9 m~10-7m之间的分散系称为胶体 | |
| B. | 电泳现象可证明胶体粒子带有电荷 | |
| C. | 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同 | |
| D. | 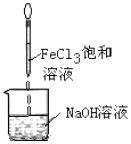 Fe(OH)3难溶于水,因此可以用如图的方法制备Fe(OH)3胶体 |
分析 A.分散质粒子直径在10-9 m~10-7m之间的分散系属于胶体;
B.胶体能吸附电荷,则胶粒带有电荷;
C.溶液无丁达尔效应,胶体有丁达尔效应;
D.氯化铁与氢氧化钠直接生成氢氧化铁沉淀,不生成胶体.
解答 解:A.分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体,故A正确;
B.胶体能吸附电荷,则胶粒带有电荷,所以电泳现象可证明胶体粒子带有电荷,故B正确;
C.溶液无丁达尔效应,胶体有丁达尔效应,可用丁达尔效应鉴别NaCl溶液和Fe(OH)3胶体,产生的现象不相同,故C正确;
D.实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和的氯化铁溶液,氯化铁与氢氧化钠直接生成氢氧化铁沉淀,故D错误;
故选D.
点评 本题考查胶体的性质,题目难度不大,注意溶液无丁达尔效应,胶体有丁达尔效应.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X分别与Y、Z、R可以形成多种二元共价化合物 | |
| B. | 元素Y、Z、R形成的化合物的水溶液可能呈酸性、碱性或者中性 | |
| C. | 热稳定性:XmY强于XmR,沸点:XmY高于XmR | |
| D. | 五种元素的单质在常温下有两种是气态、两种是固态、一种是液态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 32 g/mol | C. | 64 mol | D. | 64 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2F2的电子式: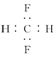 | |
| B. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I | |
| C. | 16O的原子结构示意图: | |
| D. | 间羟基苯甲醛的结构简式: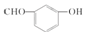 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 2mol/L HCl | B. | 500mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(Z) | n(Y) | ||
| ① | 600 | 1 | 0 | 0 | 0.8 |
| ② | 600 | 0.1 | a | 0.9 | 0.8 |
| ③ | 600 | 0 | 1.5 | 1.5 | b |
| ④ | 500 | 0.5 | 1.2 | 1.0 | c |
| A. | 实验②起始时V(逆)<v(正)且a=0.9 | |
| B. | 600℃时,该反应平衡常数K=3.2 moI/L | |
| C. | 实验③中b<1.2 | |
| D. | 若b>c,则△H<O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com