
分析 利用盖斯定律解答,利用所给反应通过加减乘除得到目标反应,并代入相关的△H即可,再求出H2燃烧热的热化学方程式.
解答 解:①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,
③2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3kJ•mol-1,
由盖斯定律可知,①-②×2+③得2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
则H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1.
点评 本题考查了盖斯定律的应用、热化学方程式的书写,题目难度不大,明确盖斯定律的含义和应用方法是解题的关键,注意把握热化学方程式的书写要求.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:实验题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
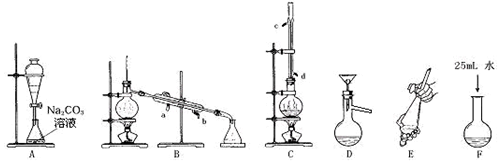
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
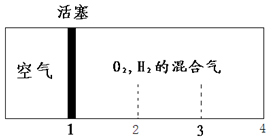 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比可能为( )| A. | 7:2 | B. | 5:4 | C. | 3:1 | D. | 2:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
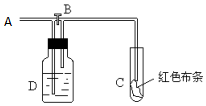 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )| A. | abc | B. | bcd | C. | abd | D. | abcd |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
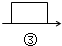 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
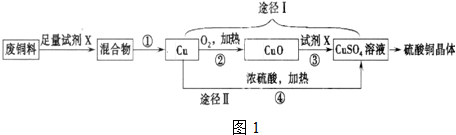

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
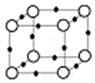 在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com