
| A. | 使酚酞试液呈红色的溶液中:K+、Na+、SO42-、NO3- | |
| B. | 使pH试纸呈红色的溶液中:Fe3+、Na+、SCN-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液中:K+、AlO2-、SO42-、NO3- | |
| D. | 加入Al粉能产生H2的溶液中:K+、Na+、AlO2-、CO32- |
分析 A.使酚酞试液呈红色的溶液,显碱性;
B.使pH试纸呈红色的溶液,显酸性,离子之间结合生成络离子;
C.AlO2-促进HCO3-的电离;
D.加入Al粉能产生H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.使酚酞试液呈红色的溶液,显碱性,该组离子之间不反应,可大量共存,故A选;
B.使pH试纸呈红色的溶液,显酸性,Fe3+、SCN-结合生成络离子,不能共存,故B不选;
C.AlO2-促进HCO3-的电离,不能大量共存,故C不选;
D.加入Al粉能产生H2的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在AlO2-、CO32-,故D不选;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答关键,侧重分析与应用能力的考查,注意复分解反应反应、络合反应的判断,题目难度不大.


科目:高中化学 来源: 题型:推断题
| X | Y | ||
| Z | W | M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 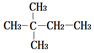 | B. | 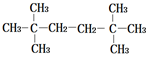 | ||
| C. | CH3CH2CH2CH2CH2CH3 | D. | CH3CH2CH2CH2CH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{576V}$ mol•L-1 | B. | $\frac{a}{125}$ mol•L-1 | C. | $\frac{250a}{36V}$mol•L-1 | D. | $\frac{250a}{48V}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭、低温是存放氨水的必要条件 | |
| B. | 实验室常用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶时,有大量气泡冒出 | |
| D. | 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ/mol,工业上采用较高温度和使用催化剂以提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
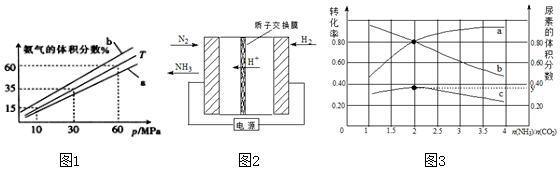
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com