
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
分析 (1)90℃时,水的离子积常数为3.8×10-13,pH=3的硫酸中c(H+)=10-3 mol/L,pH=11的NaOH溶液中c(OH-)=$\frac{3.8×1{0}^{-13}}{1{0}^{-11}}$=3.0×10-2 mol/L>10-3 mol/L,二者等体积混合后碱有剩余,溶液呈碱性,则混合溶液中的c(OH-)=$\frac{(3.8×1{0}^{-2}-1{0}^{-3})}{2}$mol/L=1.85×10-2mol/L,混合溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$;
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,混合溶液呈酸性,混合溶液中c(H+)=$\frac{0.1{V}_{2}-1{0}^{-3}{V}_{1}}{{V}_{1}+{V}_{2}}$mol/L;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,说明硫酸氢根离子不完全电离,则硫酸根离子能水解;
NaHSO4中硫酸氢根离子部分电离,H2SO4溶液与Na2SO4溶液反应生成硫酸氢钠;
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值仍然等于其系数比;再加水稀释到100倍,则稀释后c(SO42-)为5×10-9mol/L,c(H+)为10-7 mol/L.
解答 解:(1)90℃时,水的离子积常数为3.8×10-13,pH=3的硫酸中c(H+)=10-3 mol/L,pH=11的NaOH溶液中c(OH-)=$\frac{3.8×1{0}^{-13}}{1{0}^{-11}}$=3.0×10-2 mol/L>10-3 mol/L,二者等体积混合后碱有剩余,溶液呈碱性,则混合溶液中的c(OH-)=$\frac{(3.8×1{0}^{-2}-1{0}^{-3})}{2}$mol/L=1.85×10-2mol/L,混合溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{3.8×1{0}^{-13}}{1.85×1{0}^{-2}}$mol/L=2.05×10-11mol/L,
故答案为:2.05×10-11;
(2)25℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,混合溶液呈酸性,混合溶液中c(H+)=$\frac{0.1{V}_{2}-1{0}^{-3}{V}_{1}}{{V}_{1}+{V}_{2}}$mol/L=0.01mol/L,
V1:V2=90:11,故答案为:90:11;
(3)假设H2SO4是强酸,但常温下0.1mol•L-1H2SO4的溶液中c(H+)=0.11mol•L-1,说明硫酸氢根离子不完全电离,则硫酸根离子能水解,钠离子不水解,所以Na2SO4溶液呈碱性;
NaHSO4中硫酸氢根离子部分电离,其电离程度大于硫酸溶液中硫酸氢根电离程度,所以c(H+)>0.01mol•L-1,H2SO4溶液与Na2SO4溶液反应生成硫酸氢钠,离子方程式为H++SO42-=HSO4-,
故答案为:碱;>;H++SO42-=HSO4-;
(4)25℃时pH=5的H2SO4溶液加水稀释到10倍,则稀释后c(SO42-)与c(H+)的比值仍然等于其系数比为1:2;再加水稀释到100倍,则稀释后c(SO42-)为5×10-9 mol/L,c(H+)为10-7 mol/L,则再加水稀释到100倍,则稀释后c(SO42-)与c(H+)的比值=5×10-9mol/L:10-7 mol/L=1:20,
故答案为:1:2;1:20.
点评 本题考查酸碱混合溶液定性判断及溶液pH值的计算,侧重考查学生分析计算能力,难点是(4)题稀释硫酸接近中性时要考虑水的电离,为易错题.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:解答题
| 实验编号 | 待测盐酸体积(mL) | 滴入Na2CO3溶液体积(mL) |
| 1 | 20.00 | 18.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
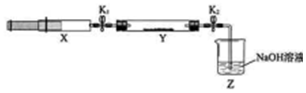
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
| 沉淀完全时的pH | 11.1 | 6.7 | 9.6 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com