
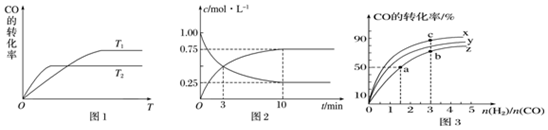
分析 (1)根据温度对化学平衡的影响来回答,先拐先平温度高T2>T1,CO转化率减小,说明升温平衡逆向进行;
②温度对化学平衡常数的影响和反应的吸放热有关,平衡逆向进行平衡常数减小;计算平衡浓度得到平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
③化学平衡正向移动可增加甲醇产率;
(2)正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;平衡常数是温度的函数,正反应是放热反应,温度越高K越小.
解答 解:(1)①反应CO(g)+2H2(g)?CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道先拐先平温度高:T2>T1,温度越高CO转化率越小,说明升温平衡逆向进行,逆反应为吸热反应,所以正反应是放热反应,△H<0,
故答案为:<;
②对于放热反应,温度越高,平衡逆向进行化学平衡常数越小,因为图象分析可知T2>T1,所以K1>K2,在T1温度下,往体积为1L的密闭容器中,充入1mol CO和2mol H2,经测得CO和CH3OH(g)的浓度随时间变化如图2所示,平衡状态下CO浓度为0.25mol/L,CH3OH(g)平衡浓度为0.75mol/L,平衡三行计算列式得到,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.75 1.5 0.75
平衡量(mol/L) 0.25 0.5 0.75
K=$\frac{0.75}{0.25×0.{5}^{2}}$=12
故答案为:>;12;
③a、若容器容积不变,升高温度,反应CO(g)+2H2(g)?CH3OH(g)平衡逆向移动,甲醇产率降低,故a错误;
b、将CH3OH(g)从体系中分离,反应CO(g)+2H2(g)?CH3OH(g)平衡正向移动,甲醇产率增大,故b正确;
c、使用合适的催化剂不会引起化学平衡的移动,甲醇的转化率不变,故c错误;
d、若容器容积不变,充入He,使体系总压强增大,单质各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故d错误;
故答案为:b;
(2)根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,
由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.5×0.5}$=4,
曲线上a、b是等温,温度高于c点的温度,所以K1═K2<K3,
故答案为:270;4;K1═K2<K3.
点评 本题是一道关于化学平衡状态的判断、化学平衡的移动影响因素、平衡状态的判断方法、化学反应平衡常数的计算和应用等方面的知识,侧重于影响平衡移动及平衡常数的因素的考查,要求学生具有分析和解决问题的能力,题目难度中等.


科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
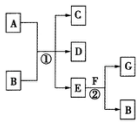 如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:
如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
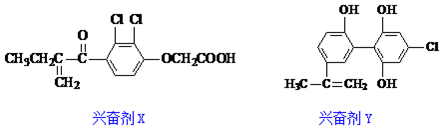
| A. | Y遇到氯化铁溶液时显紫色,但不能使溴的四氯化碳溶液褪色 | |
| B. | X既可以发生氧化反应,又可以发生还原反应 | |
| C. | 1molX与足量氢气反应,最多可消耗6molH2 | |
| D. | 1molY分子中最多有8个碳原子共面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com