为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
已知:①N
2(g)+O
2(g)═2NO(g)△H
1=+180.5kJ?mol
-1②C和C0的燃烧热(△H)分别为-393.5kJ?mol
-1和-283kJ?mol
-1则2NO(g)+2CO(g)═N
2(g)+2CO
2(g)的△H=
kJ?mol
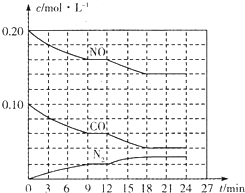
-1(2)将0.20mol NO和0.10mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示.
①CO在0-9min内的平均反应速率v(CO)=
mol?L
-1?min
-1(保留两位有效数字);第12min时改变的反应条件可能为
.
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24min时达到平衡状态,CO
2的体积分数为
(保留三位有效数字),化学平衡常数K=
(保留两位有效数字).
(3)烟气中的SO
2可用某浓度NaOH溶液吸收得到Na
2SO
3和NaHSO
3混合溶液,且所得溶液呈中性,该溶液中c(Na
+)=
(用含硫微粒浓度的代数式表示).
(4)通过人工光合作用能将水与燃煤产生的CO
2转化成HCOOH和O
2.已知常温下0.1mol?L
-1的HCOONa溶液pH=10,则HCOOH的电离常数K
a=
.

 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案