
【题目】该表是元素周期表中的一部分:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
4 |
回答下列问题:
(1)⑦是____________,原子半径最大的是____________。(填元素符号或化学式,下同)
(2)⑧⑨四种元素形成的简单离子,半径由大到小的顺序是________。
(3)上述元素中,最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的电子式____________。
(5)①和氢元素形成的化合物很多,其中C2H6可用于形成燃料电池,若用NaOH作电解质溶液,写出该燃料电池的负极反应方程式____________。
(6)CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
2CO(g)+2H2(g)。已知上述反应中相关的化学键键能数据如表:
化学键 | C-H | C=O | H-H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应产生2molH2(g)时____________(填“放出”或“吸收”)热量为____________kJ。
【答案】Si K S2->Cl->K+>Ca2+ ![]()
![]()
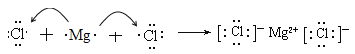 C2H6-14e-+18OH-=2CO32-+12H2O 吸收 120
C2H6-14e-+18OH-=2CO32-+12H2O 吸收 120
【解析】
根据元素在周期表中的位置可知①~分别是C、N、O、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,据此解答。
(1)⑦是Si;根据元素周期律,同周期随着核电荷数增大,原子半径逐渐减小,同主族随着核电荷数增大,原子半径逐渐增大,原子半径最大的是K;
(2)相同的电子结构,质子数越大,离子半径越小,则⑧⑨四种元素形成的简单离子,半径由大到小的顺序是S2->Cl->K+>Ca2+;
(3)非金属性越强,最高价氧化物的水化物酸性越强,故最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;金属性越强,最高价氧化物的水化物碱性越强,故碱性最强的化合物KOH,电子式为![]() ;
;
(4)用电子式表示⑤和⑨组成的化合物氯化镁的形成过程为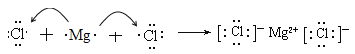 ;
;
(5)C2H6用于形成碱性燃料电池,作负极反应物生成CO32-,发生氧化反应,失电子,碳元素化合价从-3→+4,1个C2H6转移14个电子,故该燃料电池的负极反应方程式C2H6-14e-+18OH-=2CO32-+12H2O;
(6)按反应计量系数,该化学反应的反应热=反应物总键能-生成物总键能=(413×4+745×2-1075×2-436×2)kJ/mol=120 kJ/mol,则该反应产生2molH2(g)吸收热量为120kJ。


科目:高中化学 来源: 题型:
【题目】生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________;
(2)已知:C(s,石墨)+O2(g) = CO2(g) ΔH3 =-393.5 kJ/mol;
求 CO 的标准燃烧热ΔH4 = _______kJ/mol;
(3)图 1 为 1200K下, 恒容密闭容器中重晶石与石墨反应时, c(CO)随时间变化曲线图。 请分析图 1 曲线 c(CO)在 0-t2 区间变化的原因:_________________;
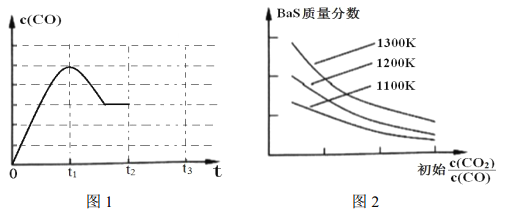
(4)图2为实验测得不同温度下, 反应体系中初始浓度比![]() 与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
A.提高 BaSO4 的投料量,可提高 BaS 的产率
B.恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态
C.减小初始浓度比![]() ,有利于增大 BaSO4 的转化率
,有利于增大 BaSO4 的转化率
D.适当升高温度,反应②的平衡左移,对生成 BaS不利
(5)图1 中, t2 时刻将容器体积减小为一半, t3 时刻达到新的平衡, 请在图 1 中画出 t2-t3 区间 c(CO)的变化曲线。________________
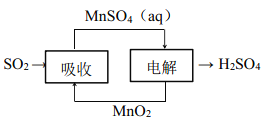
(6)工业生产中产生的 SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、Q、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外 层电子数之和为21。下列说法不正确的是

A. Q的原子半径比Y的大
B. Z的氧化物的水化物的酸性比WW的强
C. Y的氢化物可能具有强氧化性
D. Q与W或Y形成的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
A. 反应后生成的盐只为Fe(NO3)3
B. 反应后生成的盐只为Fe(NO3)2
C. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3
D. 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )

A. γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B. α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D. 三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室安卡因(G)是一种抗心率天常药物,可由下列路线合成;

(1)已知A是![]() 的单体,则A中含有的官能团是______(写名称)。B的结构简式是______。
的单体,则A中含有的官能团是______(写名称)。B的结构简式是______。
(2)C的名称(系统命名)是______,C与足量NaOH醇溶液共热时反应的化学方程式是________。
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有![]() 、_______、_______、_______。
、_______、_______、_______。
(4)F→G的反应类型是_______。
(5)下列关于室安卡因(G)的说法正确的是_______。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃,它们分子里的碳原子数相等.将1.0体积这种混合气体在氧气中完全燃烧,生成2.0体积的CO2和2.4体积的水蒸气(气体体积均在相同状况下测定),则混合气体中烷烃和烯烃的体积比为( )
A.3:1 B.1:3 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,Ka(HF)=6.0×10-4,Ksp(MgF2)=5.0×10-11。现向1 L 0.2 mol·L-1 HF溶液中加入 1 L 0.2 mol·L-1 MgCl2溶液。下列说法中正确的是( )
A. 25 ℃时,0.1 mol·L-1 HF溶液中pH=1
B. 0.2 mol·L-1 MgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C. 2HF(aq)+Mg2+(aq)![]() MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D. 该反应体系中有MgF2沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com