
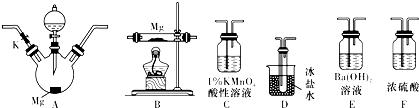
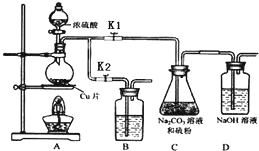
分析 探究一定浓度的硝酸与Mg反应产物:A三颈烧瓶中为镁和硝酸反应,可能得到NO2、NO、N2三种气体,若二氧化氮气体,A中有红棕色气体产生,NO2沸点为21.1℃,经过D装置冰盐水冷却生成的气体,D中出现有色液体,C中盛放1%的酸性高锰酸钾,若出现高锰酸钾褪色,说明有NO生成,氧化反应为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,经过装置F进行气体干燥,然后进入装置B进行镁和氮气的反应,再经过装置F,防止水蒸气进入B导致氮化镁水解,最后用氢氧化钡吸收尾气.
(1)E装置在该实验中为吸收尾气装置,实验中先打开开关K,通过导管向装置内通入CO2气体以排出装置内的空气,当E中出现白色沉淀,说明二氧化碳已经充满整个装置;
(2)根据实验装置中的药品及实验的目的确定所选用的仪器的正确连接方式,二氧化氮为红棕色气体,确定还原产物中有NO2的现象是A中有红棕色气体产生(或D中出现有色液体),氮化镁易水解,第二次使用F的目的是防止水蒸气进入B导致氮化镁水解;
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,根据质量守恒和得失电子守恒配平;
(4)根据镁能和二氧化碳反应分析,镁条与二氧化碳反应会生成碳与氧化镁;
(5)检验氮气的生成,可通过检验氮气和镁反应的产物氮化镁,氮化镁易水解生成氢氧化镁和氨气,根据检验氨气的存在间接检验氮气.
解答 解:(1)探究一定浓度的硝酸与Mg反应产物,E装置在该实验中为吸收尾气装置,实验中先打开开关K,通过导管向装置内通入CO2气体以排出装置内的空气,当E中出现白色沉淀,说明二氧化碳已经充满整个装置,已经全部排出装置内的空气,需停止通入CO2,
故答案为:E中出现白色沉淀;
(2)探究一定浓度的硝酸与Mg反应产物:A三颈烧瓶中为镁和硝酸反应,可能得到NO2、NO、N2三种气体,若二氧化氮气体,A中有红棕色气体产生,经过D装置冰盐水冷却生成的气体,D中出现有色液体,C中盛放1%的酸性高锰酸钾,若出现高锰酸钾褪色,说明有NO生成,氧化反应为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,经过装置F进行气体干燥,然后进入装置B进行镁和氮气的反应,再经过装置F,防止水蒸气进入B导致氮化镁水解,最后用氢氧化钡吸收尾气,所选用的仪器的正确连接方式是:A→D→C→F→B→F→E,氮化镁易水解,第二次使用F的目的是防止水蒸气进入B导致氮化镁水解,
故答案为:D→C→F→B→F;防止水蒸气进入B导致氮化镁水解;
(3)C中溶液颜色慢慢褪去,为NO和高锰酸根离子反应氧化还原反应,该反应中,反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;NO→NO3-,N由+2价变成+5价,一个NO分子失去3个电子,所以其最小公倍数为15,故MnO4-的计量数为3,NO的计量数为5,然后根据原子守恒配平其它元素,配平后的离子方程式为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O,
故答案为:5NO+4H++3MnO4-═3Mn2++5NO3-+2H2O;
(4)镁条与二氧化碳发生置换反应,生成碳与氧化镁,反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,所以在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是装置中充满CO2,而加热时CO2也能与Mg反应,
故答案为:装置中充满CO2,而加热时CO2也能与Mg反应;
(5)镁与硝酸反应时若有氮气生成,则生成的氮气和镁反应生成氮化镁,氮化镁易水解生成氨气,所以取少量B中反应后的固体放入试管中,再向试管中滴加适量的水并将湿润的红色石蕊试纸靠近试管口处,试纸变蓝,说明有氮气生成,
故答案为:取少量B中反应后的固体放入试管中,再向试管中滴加适量的水并将湿润的红色石蕊试纸靠近试管口处,试纸变蓝.
点评 本题考查反应产物的测定、对实验原理与装置的理解、实验方案设计等,题目难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②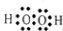 ③
③ ④
④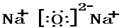 ⑤
⑤ ⑥
⑥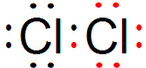 ⑦
⑦
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电解质溶液 | H2SO4溶液 | KOH溶液 |
| 负极反应式 | ||
| 正极反应式 | ||
| 溶液的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com