
正误判断,正确的划“√”,错误的划“×”
(1)1 L水中溶解5.85 g NaCl所形成的溶液的物质的量浓度是0.1 mol·L-1( )
(2)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25%( )
(3)在100 mL的烧杯中,加入10 g食盐,然后注入90 mL的水,充分溶解后,所得溶质的质量分数为90%( )
(4)将40 g SO3溶于60 g水中所得溶质的质量分数为40%( )
(5)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 mol·L-1( )
(6)T ℃时100 g饱和食盐水中,含有NaCl的质量为m g,则该温度时,NaCl的溶解度是m g( )
科目:高中化学 来源: 题型:
下列元素间,能以离子键结合生成A2B型离子化合物的是( )
A.原子序数为11和17
B.原子序数为20和9
C.原子序数为13和17
D.原子序数为19和16
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)常温常压下,3.2 g O2所含的原子数为0.2NA( )
(2)标准状况下,18 g H2O所含的氧原子数目为NA( )
(3)常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA( )
(2012·新课标全国卷,9C)
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列条件下,两种气体的分子数一定相等的是( )
A.同密度、同压强的N2和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的C2H4和CO
D.同压强、同体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Cl2参加的任何反应转移电子数都是2NA
B.标准状况下,22.4 mL水中含有的分子数目约为1.24NA
C.常温常压下,29 g乙基(—C2H5)所含电子数为13NA
D.0.2 mol Na2O2中含有离子总数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.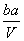 mol·L-1 B.
mol·L-1 B.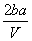 mol·L-1
mol·L-1
C.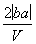 mol·L-1 D.
mol·L-1 D.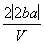 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
正误判断,正确的划“√”,错误的划“×”
(1)使用托盘天平称量药品,都不能直接放在托盘中,均应放两张相同的纸片( )
(2)定容时,往容量瓶中缓慢加蒸馏水,等液面离容量瓶刻度线1~2 mL时,改用胶头滴管滴加蒸馏水( )
查看答案和解析>>
科目:高中化学 来源: 题型:
20 ℃时,饱和NaCl溶液的密度为ρ g·cm-3,物质的量浓度为c mol·L-1,则下列说法中错误的是( )
A.温度低于20 ℃时,饱和NaCl溶液的浓度小于c mol·L-1
B.20 ℃时,饱和NaCl溶液的质量分数为 ×100%
×100%
C.20 ℃时,密度小于ρ g·cm-3的NaCl溶液是饱和溶液
D.20 ℃时,饱和NaCl溶液的溶解度S= g/100 g水
g/100 g水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com