
| A. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向Mg(HCO3)2溶液中加入过量澄清石灰水:Mg2++2HCO3-+2OH-+Ca2+=MgCO3↓+CaCO3↓+2H2O | |
| C. | 氧化铁溶氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O | |
| D. | 明矾溶液与Ba(OH)2溶液混合:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
分析 A.铁离子在沸水中发生水解反应生成氢氧化铁胶体;
B.氢氧化镁比碳酸镁更难溶,氢氧化钙过量,反应生成氢氧化镁沉淀;
C.二者发生氧化还原反应生成亚铁离子和碘单质;
D.氢氧化钡少量时,明矾与氢氧化钡溶液反应生成硫酸钡、氢氧化铝沉淀.
解答 解:A.向沸水中滴加饱和的氯化铁溶液,铁离子发生水解反应生成氢氧化铁胶体,反应的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故A正确;
B.向Mg(HCO3)2溶液中加入过量澄清石灰水,反应生成氢氧化镁、碳酸钙沉淀,正确的离子方程式为:Mg2++2HCO3-+4OH-+2Ca2+=Mg(OH)2↓+2CaCO3↓+2H2O,故B错误;
C.氧化铁溶于氢碘酸溶液中,反应生成碘单质、亚铁离子和水,反应的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故C正确;
D.明矾溶液与Ba(OH)2溶液混合,氢氧化钡少量时生成氢氧化铝沉淀,反应的离子飞方程式为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓,故D正确;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:填空题
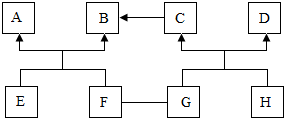
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有新的物质生成 | |
| B. | 必然发生旧化学键断裂,新化学键形成 | |
| C. | 原子的数目可能有变化 | |
| D. | 必然伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
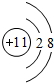 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 | |
| B. | 一束可见光透过胶体时,有丁达尔效应产生 | |
| C. | 胶体属于混合物 | |
| D. | 氢氧化铁胶体能吸附水中的悬浮颗粒并沉淀,因此常用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
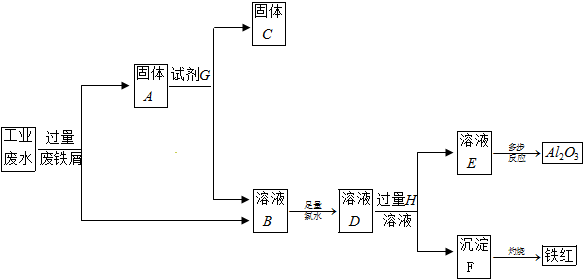
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经测定某物质只含一种元素,则该物质一定是单质 | |
| B. | 阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物 | |
| C. | 既能和酸反应又能和碱反应的化合物一定为两性化合物 | |
| D. | 酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下甲烷和氧气的密度之比为2:1 | |
| B. | 1g甲烷和1g氧气的原子数之比为5:1 | |
| C. | 等物质的量的甲烷和氧气的质量之比为2:1 | |
| D. | 在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com