
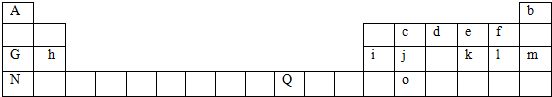
族 周期 | ||||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar元素.
(1)稀有气体的化学性质最不活泼;
(2)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(3)金属性越强,最高价氧化物对应水化物的碱性越强;
(4)元素⑦的氢化物为水,该常温下钾与水反应生成KOH与氢气,氯气与水反应生成HCl与HClO;
(5)⑨的最高价氧化物对应水化物的化学式为HBrO4;①和⑨两元素形成化合物为NaBr,含有钠元素,该化合物灼烧时火焰颜色为黄色,溴化钠与氯气反应生成氯化钠与溴单质;
(6)①和⑤最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar元素.
(1)稀有气体Ar原子核外电子结构稳定,所以Ar的化学性质最不活泼,故答案为:Ar;
(2)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:K+>Ca2+>Mg2+,故答案为:K+>Ca2+>Mg2+;
(3)金属性Na>Mg>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(4)元素⑦的氢化物为H2O,该常温下钾与水反应生成KOH与氢气,反应方程式为:2K+2H2O=2KOH+H2↑,氯气与水反应生成HCl与HClO,反应方程式为:Cl2+H2O=HCl+HClO,
故答案为:H2O;2K+2H2O=2KOH+H2↑;Cl2+H2O=HCl+HClO;
(5)⑨的最高价氧化物对应水化物为NHBrO4,①和⑨两元素形成化合物为NaBr,含有钠元素,焰色反应为黄色,溴化钠与氯气反应生成氯化钠与溴单质,离子反应方程式为:2Br-+Cl2═2Cl-+Br2,故答案为:HBrO4;NaBr;黄色;2Br-+Cl2═2Cl-+Br2;
(6)①和⑤最高价氧化物对应水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律,难度不大,侧重对基础知识的巩固,注意对元素周期律的理解,知道氢氧化铝的两性.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其气态氢化物溶于水显碱性.(填“酸”或“碱”)
,其气态氢化物溶于水显碱性.(填“酸”或“碱”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )
T°C时,在一固定容积的密闭容器中发生反应:A(g)+B(g)?X(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,则判断正确的是( )| A. | T℃时,该反应的平衡常数值为4 | |
| B. | c点没有达到平衡,此时反应向逆向进行 | |
| C. | 若c点为平衡点,则此时容器内的温度高于T℃ | |
| D. | T℃时,在d点加入一定量X可达到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、玻璃和水泥都是无机非金属材料;青铜、碳素钢和石英都是合金 | |
| B. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 | |
| C. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| D. | 食盐可作调味剂,也可作食品防腐剂;福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3═NH3↑+CO2↑+H2O | B. | NH3+HCl=NH4Cl | ||
| C. | 2KOH+Cl2=KCl+KClO+H2O | D. | 2K2O2+2CO2=2K2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com