
【题目】把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率没有影响的是( ) 
A.H+的浓度
B.镁条的表面积
C.溶液的温度
D.Cl﹣的浓度
【答案】D
【解析】解:由图可知,产生H2速率先增大后减小,为Mg+2H+═Mg2++H2↑ A、开始盐酸的浓度较大,反应速率快,但随反应的进行,浓度减小,则反应速率减小,故A正确;
B、由反应可知Mg参加反应,开始接触面积大,反应速率快,但随反应的进行,接触面积减小,则反应速率减小,故B正确;
C、反应开始H+离子浓度最大,随着反应进行浓度会逐渐减小,但反应速率逐渐增大,因该反应为放热反应,放热使温度升高,则反应速率加快,故C正确;
D、因Cl﹣不参加反应,Cl﹣的浓度增大或减小都不影响化学反应速率,且该反应中Cl﹣的浓度不变,故D错误;
故选:D.
由图可知,产生H2速率先增大后减小,利用反应实质为Mg+2H+═Mg2++H2↑及影响反应速率的因素来分析.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1(NH4)2SO4溶液中逐滴加入0.2000molL﹣1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 
A.点a所示溶液中:c(NH4+)>c(SO42﹣)>c(OH﹣)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O)+c(OH﹣)
D.点d所示溶液中:c(SO42﹣)>c(NH3H2O)>c(NH4+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1 , 则下列判断正确的是( )
A.c1:c2的值不能确定
B.平衡时,Y和Z的生成速率之比为1:1
C.0.48molL﹣1<c1+c2+c3<0.56molL﹣1
D.c1的取值范围为0<c1<0.14 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子[CuCl2]﹣ . 受潮露置空气中迅速氧化成碱式盐.实验室用下列流程制备: 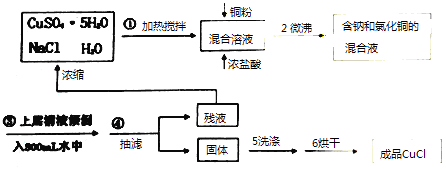
注:①实验药品:硫酸铜晶体12.5g、氯化钠晶体6.0g、水200mL、铜粉3.5g、浓盐酸10mL.
②Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓ (白色沉淀).
NaCl+CuCl↓ (白色沉淀).
请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式 .
(2)判断步骤②反应完全的现象是 .
(3)步骤④有关抽滤操作,下列说法正确的是 .
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C.抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是 .
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是 .
(6)氯化亚铜的定量分析:
①取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸锶铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为 . (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于某可逆反应的下列叙述中,不能说明反应一定达到平衡的是( )
A. 正反应速率与逆反应速率相等
B. 反应物的浓度与生成物的浓度不再改变
C. 在给定条件下反应达到最大限度
D. 反应物的浓度与生成物的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,发生“先产生沉淀,后沉淀又溶解”现象的是
①向AlCl3溶液中通入过量的NH3 ②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向水玻璃中逐滴加入过量的盐酸 ④向Ca(OH)2溶液中通入过量的CO2
A.②④B.①④C.①③D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:请回答下列问题:
3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.
3Zn(OH)2+2Fe(OH)3+4KOH.
(1)高铁电池的负极材料是 .
(2)放电时,正极发生(填“氧化”或“还原”)反应;已知负极反应为Zn﹣2e﹣+2OH﹣═Zn(OH)2 , 则正极反应为 .
(3)放电时,(填“正”或“负”)极附近溶液的碱性增强.
(4)充电时,阴极的电极反应式为 .
(5)充电时,理论上分析,每生成0.15moLK2FeO4转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将相同物质的量的NaCl、CO2、NH3在30℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )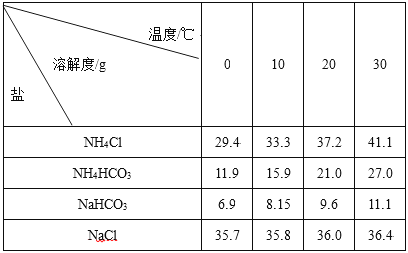
A.NH4Cl
B.NH4HCO3
C.NaHCO3
D.NaCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com