
【题目】氮的氧化物参与雾霾的形成,利用CO和H2在一定条件下可将NO转化为无害物质。回答下列问题:
(1)汽车气缸中发生复杂的化学反应,其中有如下三个重要反应:
反应1:N2(g)+O2(g)![]() 2NO(g) △H=+180.5kJ/mol
2NO(g) △H=+180.5kJ/mol
反应2:2CO(g)![]() 2C(s)+O2(g) △H=+221 kJ/mol
2C(s)+O2(g) △H=+221 kJ/mol
反应3:C(s)+O2(g)![]() CO2(g) △H=-393.5 kJ/mol
CO2(g) △H=-393.5 kJ/mol
①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=___________。
N2(g)+2CO2(g)的△H=___________。
②下列有关反应1的说法中正确的是___________。
A.反应物的总键能小于生成物的总键能
B.正反应的活化能大于逆反应的活化能
C.使用催化剂可使反应1的反应热减小
D.其它条件不变,加压,正逆反应速率不变,平衡不移动
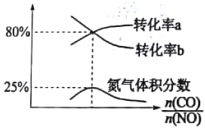
③定温定容条件下,向容积为1L的密闭容器中充入一定量的NO和CO的混合气体(总物质的量保持4mol),平衡时NO、CO的转化率及N2的体积分数与![]() 的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
的关系如图所示,CO转化率对应的曲线为___________(填“转化率a”或“转化率b”,氮气体积分数25%时该反应的平衡常数K=___________,初始时n(NO)=___________.
(2)1073K时,H2与NO可发生反应2NO(g)+2H2(g)![]() N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
N2(g)+2H2O(g),该反应的正反应速率方程为:v=kca(H2)×cb(NO)(a、b分别为H2和NO的级数,k为速率常数)。
在定容容器中,分别充入不同浓度的NO和H2,测得该反应的正反应速率如下表所示:
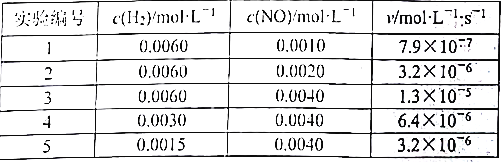
利用上表数据可确定a=___________(保留整数),b=___________(保留整数),k=___________(保留两位有效数字)。
【答案】-746.5kJ/mol B 转化率b 80L/mol 2mol 1 2 ![]()
【解析】
本题主要考查盖斯定律的计算、对方热概念的理解,可从三段式计算和平衡常数计算角度入手。
(1)①由盖斯定律,2×反应3+反应2-反应1可得目标反应式2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的△H=-393.5×2+221-180.5=-746.5kJ/mol;
N2(g)+2CO2(g)的△H=-393.5×2+221-180.5=-746.5kJ/mol;
②反应1正向为吸热反应,反应物的总键能大于生成物的总键能,A项错误;反应热等于正反应的活化能与逆反应的活化能之差,△H>0,正反应的活化能大于逆反应的活化能,B项正确;催化剂不改变反应热,C项错误;加压,正逆反应速率变大,D项错误;
③随着![]() 增大,即CO含量增大时,NO转化率必然增大,所以CO对应转化率b的曲线。
增大,即CO含量增大时,NO转化率必然增大,所以CO对应转化率b的曲线。
由三段式计算,设初始时n(NO)=a mol,
2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量(mol): a 4-a 0 0
变化量(mol): 0.8a 0.8a 0.4a 0.8a
平衡量(mol): 0.2a 4-1.8a 0.4a 0.8a
由图中信息可知,氮气体积分数为25%时,NO和CO转化率均为80%,所以80%=0.8a/(4-a),解出a=2。因为容器的体积为1L,故平衡常数![]() L/mol。
L/mol。
故本题答案为:-746.5kJ/mol;B;转化率b;80L/mol;2mol
(2)由第3、4、5组数据可看出c(H2)与v成正比关系,故a=1;由第1、2、3组数据可看出c2(NO)与v成正比,故b=2;将5组数据带入后求出k平均值为![]() 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关酯化反应的说法正确的是( )
A.醇与酸的反应都是酯化反应
B.酯化反应和中和反应原理一样
C.酯化反应既属于取代反应,也属于可逆反应
D.酯化反应的机理是羧酸去掉氢原子而醇去掉羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某合作学习小组对物质进行的分类,正确的是
A. 冰、水混合是混合物B. 盐酸、食醋既是化合物又是酸
C. 不锈钢和我们日常生活中使用的硬币都是合金D. 纯碱和熟石灰都是碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】格氏试剂RMgX由Mg和卤代烃RX在干燥下的乙醚中反应制得,广泛用于复杂有机物的合。下图是著名香料(![]() )的合成路线。
)的合成路线。

(1)写出反应Ⅰ的反应条件____,反应Ⅱ的反应类型为____,化合物C的名称是____。
(2)写出下列物质的结构简式: E____ , F____。
(3)写出苯 → C的化学方程式:____
(4)A有多种同分异构体,其中苯环上有两种化学环境氢的同分异构体(含-MgBr结构)有____种。
(5)设计原料(![]() )合成产物(
)合成产物( )的合成路线:____
)的合成路线:____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图
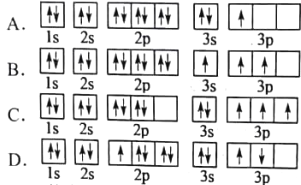
其中能量最低的是___________(填字母),电子由状态C到状态B所得原子光谱为___________光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合____________________________________________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
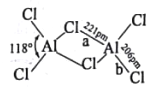
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为 ___________________。
(3)冰晶石属于离子化合物,由Na+和AIF63-组成,在冰晶石的晶胞中,AlF63-占据的位置相当于氯化钠晶胞中Cl-的位置。
①冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95g/cm3,则冰品石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 60gSiO2晶体中含有4NA条硅氧键
B. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
C. 25℃时,pH=13的Ba(OH)2溶液中含有的OH-离子数为0.1 NA
D. K35ClO3与浓H37Cl反应制得7.2gCl2,则生成的Cl2分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A. 炼铁高炉中所发生的反应都是放热的,故无需加热
B. 由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
C. 金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
D. 可以用钠加入氯化镁饱和溶液中制取镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组化合物,所含化学键类型不完全相同的是( )
A.NH3、H2O、CH3COOH
B.NH3、HNO3、CH3CH2OH
C.CH3COONH4、NH3、Na2O2
D.CaCl2、NaH、Na2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com