
| A. | y=1×a% | B. | y=1-1×a% | C. | y=1×a%=0.5 | D. | y=1-1×a%<0.5 |
分析 发生反应:C2H4+H2→C2H6,由方程式可知,若恰好反应时,则减少体积=V(C2H4)=(H2),若乙烯过量,则减少体积=V(H2),剩余气体体积=V(C2H4),若氢气过量,则减少体积=V(C2H4),剩余气体体积=V(H2),据此讨论计算.
解答 解:乙烯在1 L混和气体中的体积分数为a%,即乙烯为a% L,则氢气为(1-a%)L,
发生反应:C2H4+H2→C2H6,
若恰好反应,则二者按1:1反应,减少体积=V(C2H4)=(H2)=0.5L,则a% L=(1-a%)L=yL=0.5L,解y=a%=(1-a%)=0.5;
若乙烯过量,则V(C2H4)>0.5L,即a%>0.5,则减少体积=V(H2),剩余气体体积=V(C2H4),则y=1×a%>0.5,
若氢气过量,则:V(C2H4)<0.5L,即a%<0.5,则:减少体积=V(C2H4),剩余气体体积=V(H2),则y=1×(1-a%)>0.5,
由上述分析,可知ABC正确,D错误,
故选D.
点评 本题考查混合物计算,属于讨论型题目,为易错题目,关键是根据方程式分情况讨论,结合差量法计算解答.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:解答题
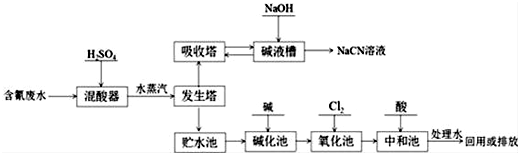
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| B. | NH4HS溶液与少量的NaOH溶液反应:NH4++OH-=NH3•H2O | |
| C. | 稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+$\frac{\underline{\;\;△\;\;}}{\;}$SO2↑+S↓+H2O | |
| D. | 过量Cl2通入Fel2溶液中:3Cl2+2I-+4Fe2+=4Cl-+I2+4Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有①② | C. | 只有②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | NaF | NaI | MgO |
| 离子所带电荷数 | 1 | 1 | 2 |
| 离子核间距离/10-10m | 2.31 | 3.18 | 2.10 |
| A. | NaF>NaI>MgO | B. | MgO>NaF>NaI | C. | MgO>NaI>NaF | D. | NaI>NaF>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
 (3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.
(3)向c组试验后的容器中加入78mL 1.0mol/L的氢氧化钠溶液,可恰好使剩余合金中的铝完全溶解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压强不再发生变化 | |
| B. | 平衡时A2、B2、AB的浓度之比是1:1:2 | |
| C. | 单位时间内生成nmol A2的同时生成nmol B2 | |
| D. | 单位时间内有n个A-A断裂的同时有2n 个A-B断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、NO3- | B. | K+、Na+、Cl-、NO3- | ||
| C. | NH4+、AlO2-、Na+、CH3COO- | D. | Fe3+、S2-、Al3+、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com