
| A、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| B、在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
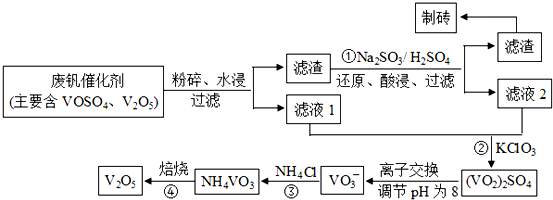
| 物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、②③④ |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、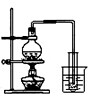 制取少量蒸馏水 |
B、 用铜和浓硝酸混合制取少量NO2 |
C、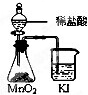 比较MnO2、Cl2、I2的氧化性 |
D、 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9.0L | B、13.5L |
| C、10.7L | D、16.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、② | C、②③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
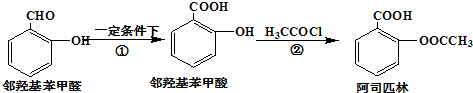
| A、与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3种 |
| B、用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① |
| C、反应②中加入过量的NaHCO3有利提高阿司匹林的产率 |
| D、1mol阿司匹林最多可以和2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
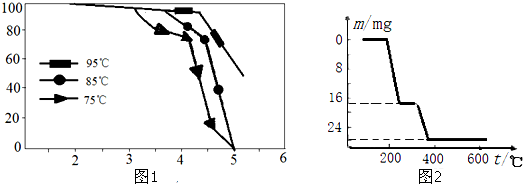
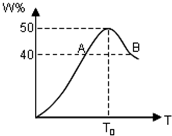 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:. |
| v |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com