
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| D. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN |
分析 图表中数据分析可知,酸性大小为:HCOOH>H2S>HCN>HS-,
A.等体积、等pH的HCOOH和HCN溶液中,HCN溶液溶质浓度大;
B.HCOO-、CN-、HS-离子都是弱酸阴离子,酸性HCOOH>HS-,离子间不发生反应;
C.溶液中存在物料守恒,n(Na)=n(S);
D.等体积、等浓度的HCOONa和NaCN两溶液中阴离子水解程度不同,水的电离程度不同,结合电荷守恒分析判断.
解答 解:A.等体积、等pH的HCOOH和HCN溶液中,HCN溶液溶质浓度大,恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故A错误;
B.酸性HCOOH>HS-,离子间不发生反应,HCOO-、CN-、HS-在溶液中可以大量共存,故B错误;
C.NaHS溶液中加入适量KOH后反应生成硫化钾和硫化钠,但硫化钠溶液中存在物料守恒,c(Na+)═c(H2S)+c(HS-)+C(S2-),故C错误;
D.HCOO-水解程度小于CN-,则HCOONa溶液中氢氧根离子浓度小于NaCN溶液中氢氧根离子浓度,溶液中存在电荷守恒:c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),钠离子浓度相同,HCOONa溶液中氢离子浓度大于NaCN溶液中氢离子浓度,则HCOONa溶液中离子总浓度大于NaCN溶液中离子总浓度,故D正确;
故选D.
点评 本题考查了弱电井电离平衡、电离程度大小比较和盐类水解的应用、电解质溶液中电荷守恒、物料守恒分析,掌握基础是解题关键,题目难度中等,侧重于考查学生的分析能力和应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-55.6 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6 kJ•mol-1 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-889.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | |
| B. | 锌为负极,Ag2O为正极 | |
| C. | 原电池工作时,溶液中OH- 移向正极 | |
| D. | 原电池工作时,溶液中电子由负极流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
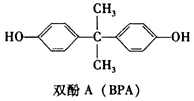
| A. | 双酚A分子的核磁共振谱有4组峰 | |
| B. | 双酚A分子中所有的碳原子可能共平面 | |
| C. | 1mol双酚A最多可与2molBr2反应 | |
| D. | 双酚A与足量H2反应的产物属于芳香醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试剂 | 乙醚 | 乙醇 | 甲酸 | 甲酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 100.5 | 54.4 |
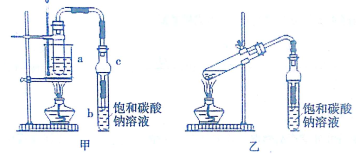
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | B. | H2(g)+F2(g)=2HF(g)△H=25kJ•mol-1 | ||
| C. | 表中最稳定的共价键是H-F | D. | H2(g)→2H(g)△H=+436kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com