
(8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素;F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的价电子排布式 。
(2) B和C比较,第一电离能较大的是 (填元素符号),其原因为 。
(3)甲、乙两分子的中心原子的杂化类型是否相同 (相同、不相同)。
(4)已知化合物丁熔点190℃,沸点183℃。丙和丁比较,熔点较高的是 (填化学式),
(5)配合物戊由G3+与甲、元素F构成,已知该配合物的配位数为6。在含有0.1mol戊的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀。,则戊的化学式为 。
(1)3d54s1 (2)N;N 原子价电子为2s22p3,2p轨道半充满,能量较低,难失1个电子,O原子价电子为2s22p4,易失1个电子;(3)相同;(4)NaCl;(5)[Cr(H2O)5Cl]Cl2
【解析】
试题分析:根据题意可推出:A是H;B是N;C是O;D是Na;E是Al;F是Cl;G是Cr。甲是H2O;乙是H2O2;丙是NaCl;丁是AlCl3.(2)24号元素Cr基态原子的价电子排布式3d54s1; (2)一般情况下,同一周期的元素,元素的非金属性越强,其第一电离能越大,但是由于N原子核外的2p轨道上的电子处于半充满的稳定状态,能量较低,所以失去电子较难,因此N和O比较,第一电离能较大的是N;(3)在H2O和H2O2两分子的中心原子O的杂化类型是相同的,都是sp3杂化。(4)NaCl是离子晶体;而AlCl3.是分子晶体,分子晶体中分子之间通过分子间作用力结合,而离子晶体中离子之间通过离子键结合,离子键是一种强烈的相互作用,断裂较难,因此熔点较高的是NaCl。(5)在0.1mol戊电离产生的Cl-的物质的量为:n(Cl-)=n(AgCl)= 28.7g÷143. 5g/mol=0.2mol,因此在一个戊的外围含有2个Cl-.由于配合物戊由Cr3+与甲、元素F构成,已知该配合物的配位数为6。所以在其络离子中含有一个Cl-.其余的是水分子。因此根据化合物中正负化合价的代数和为0的原则,可知该络合物的化学式是[Cr(H2O)5Cl]Cl2。
考点:考查元素及化合物的推断、第一电离能的比较、原子的杂化方式、熔沸点的比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如下图(反应条件及其它产物已略去)。
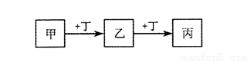
下列说法不正确的是
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2,则甲可能为Mg
D.若丁是O2,则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
既可用来鉴别甲烷与乙烯,又可除去甲烷中混有乙烯的最佳方法是( )
A.通入酸性高锰酸钾溶液中 B.通入足量溴水中
C.一定条件下通入H2 D.点燃
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:计算题
( 13分)下面的表格是元素周期表的一部分,其中的字母对应不同的元素。
A |
|
| |||||||||||||||
|
|
|
| M | Q | R |
|
| |||||||||
|
| E |
|
|
| D |
| ||||||||||
|
|
| G |
|
|
| J |
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)G和J形成的合金是一种贮氢材料,其晶体结构与氯化铯相同。该合金中每个G原子周围与其最近且等距的J原子有 个。该晶体属于 晶体
A .离子晶体 B . 原子晶体 C . 分子晶体 D. 金属晶体
(2)M3R2是一种直线型分子R=M=M=M=R,该分子是一种 分子(填极性或非极性)。
(3)请写出D-的电子排布式: 。
(4)M2A2也是直线型分子,1个分子中含有 个σ键。
(5)化合物E2D6分子中各原子均达到了八电子稳定结构,请画出其结构式。(用元素符号表示)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色。将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。
下列说法不正确的是
A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失
B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。
C.②红色褪去的原因是SO2具有漂白性
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
B.滴入酚酞试液显红色的溶液中:K+、Fe3+、ClO-、SO42-
C.c(H+)/c(OH-)=1×1012的溶液中:NH4-、Cl-、NO3-、Al3+
D.由水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
下列关于粒子结构的描述正确的是
A.NF3和BF3是中心原子杂化类型相同的极性分子
B.CH2Cl2和C2H4是空间构型不同的非极性分子
C.在SiO2晶体中,Si原子与Si—O键数目比为1︰2
D.CF4和CO2是含极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列叙述中能肯定A金属比B金属金属性强的是 ( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多
D.常温时,A能从水中置换出氢,而B不能
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作正确的是 ( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸 ②将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基 ③实验室制硝基苯要把温度计插在烧杯热水的中部 ④可用FeCl3溶液除去试管内难以刷去的铜迹 ⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较 ⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 ⑦蒸馏时,应使温度计水银球上缘与蒸馏烧瓶支管口下缘相平
A.①④ B.③④⑥⑦ C.①③ D.②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com