
【题目】W、X、Y、Z四种短周期元素,它们在周期表中位置如图所示,下列说法错误的是( )

A.Z、Y、X的原子半径依次减小,非金属性依次降低
B.Z、Y、W的最高价氧化物的水化物的酸性依次降低
C.W与Y两种元素都存在多种同素异形体
D.Y的气态氢化物与Z的单质在一定条件下可发生氧化还原反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印刷行业重要的还原剂,易溶于水,难溶于乙醇;高铁酸钾(K2FeO4)是一种绿色环保型饮用水处理剂。某课题小组拟以硫铁矿(主要成分是FeS2)为主要原料制备连二亚硫酸钠和高铁酸钾,其简易工艺流程如下(部分步骤和条件略去):
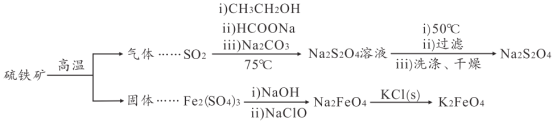
(1)FeS2中含有S22-离子,其电子式为_____。“气体”的主要成分是O2、SO2和N2,参考表中的数据,简述工业上用物理方法分离提纯二氧化硫的实验方案:_____
熔点/℃ | 沸点/℃ | 密度/gL-1(标准状况) | |
O2 | -218 | -183 | 1.429 |
SO2 | -76 | -10 | 2.9 |
N2 | -210 | -196 | 1.25 |
(2)SO2→Na2S2O4步骤中氧化剂与还原剂的物质的量之比为_____。制得的Na2S2O4溶液冷却至50℃,过滤,用_____洗涤,干燥,制得Na2S2O4。
(3)Na2FeO4与KC1发生复分解反应制备K2FeO4,说明相同温度下K2FeO4的溶解度_____(填“ > ”、“ < ”或=”) Na2FeO4的溶解度。
(4)溶液中的Na2S2O4易被空气中的氧气氧化生成NaHSO3,反应的离子方程式为_____
(5)在制备Na2FeO4时,现象是先生成红褐色沉淀,随后转化成绿色溶液,生成了 Na2FeO4。
①写出红褐色沉淀转化为Na2FeO4的化学方程式:_____。
②为探究Na2FeO4和Cl2的氧化性相对强弱,取少量上述绿色溶液于试管中,滴加适量浓盐酸,产生能使湿润的KI淀粉试纸变蓝色的气体,不能说明Na2FeO4的氧化性比Cl2的氧化性强,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会_____能量;新的化学键形成会_____能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al![]() 2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
|
|
装置Ⅰ | 装置Ⅱ |
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是_____。
②装置Ⅱ中,正极的电极反应式为______。
③关于装置Ⅱ,下列叙述正确的是______(填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。
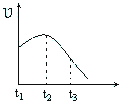
A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列各项中的物质均在标准状况下,有关判断正确的是( )
A. 16.8 L CH4和CO2的混合气体中含有的碳原子数为0.75NA
B. 4.6 g NO2和CH3CH2OH的混合物中含有的分子数为0.1NA
C. 5.6 L SO3中含有的电子数为30NA
D. 11.2 L氖气中含有的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:5C2O42-+2MnO4-+16H+ = 2Mn2++10CO2↑+8H2O。某研究小组通过如下实验步骤测定晶体A(KxFey(C2O4)z·aH2O,其中的Fe元素为+3价)的化学式:
步骤1:准确称取A样品9.820 g,分为两等份;
步骤2:取其中一份,干燥脱水至恒重,残留物质量为4.370g;
步骤3:取另一份置于锥形瓶中,加入足量的3.000 mol·L-1 H2SO4溶液和适量蒸馏水,使用0.5000 mol·L-1 KMnO4溶液滴定,滴定终点消耗KMnO4溶液的体积为24.00 mL;
步骤4:将步骤1所得固体溶于水,加入铁粉0.2800 g,恰好完全反应。
通过计算确定晶体A的化学式(写出计算过程) _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是___。
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。
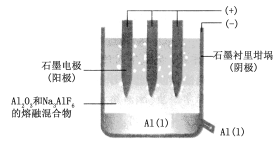
①写出电解时阳极的电极反应式:___。
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为___mol,生成的二氧化碳的物质的量为___mol。
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为___。
②以NaOH溶液为电解质溶液时,负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A. CH3COOH溶液中加入少量CH3COONa固体,溶液的pH值升高
B. 浓度均为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)- c(CH3COOH)=2[c(H+)-c(OH-)]
C. 将pH=a的醋酸稀释为pH=a+1的过程中,c(CH3COOH)/ c(H+)减小
D. 等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2022年前后我国将建成首座载人空间站。为实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家研发了一种能量转化装置,总反应方程式为2CO2=2CO+O2。下列说法正确的是( )

A.该装置将太阳能直接转化为化学能
B.离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的pH不变
D.Y电极的反应:CO2+2e-+H2O=CO+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com