
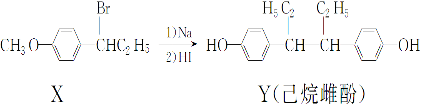
| A. | 在NaOH 水溶液中加热,化合物X 可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与浓溴水发生取代反应 | |
| C. | 用FeCl3溶液不能鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
分析 A.X为卤代烃,在氢氧化钠水溶液中发生水解反应生成醇;
B.Y含有酚羟基,与苯酚性质相似;
C.Y含有酚羟基,可与氯化铁发生显色反应;
D.根据手性碳原子的定义判断.
解答 解:A.X为卤代烃,在氢氧化钠水溶液中发生水解反应生成醇,如发生消去反应,条件为氢氧化钠醇溶液,故A错误;
B.Y含有酚羟基,与苯酚性质相似,可与浓溴水发生取代反应,故B正确;
C.Y含有酚羟基,可与氯化铁发生显色反应,故C错误;
D.连接四个不同的原子或原子团的碳原子为手性碳原子,Y中连接乙基的碳原子为手性碳原子,故D错误.
故选B.
点评 本题为2015年江苏考题第12题改编题,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该类题目的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1mol/L 1mol/L 1mol/L | B. | 1mol/L 4mol/L 9mol/L | ||
| C. | 1mol/L 2mol/L 3mol/L | D. | 体积未知,无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )
现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )| A. | Al、Mg、SiO2、Zn | B. | Al、Fe、Zn、Na | C. | Al、Na、Cu、Fe | D. | Al、Cu、Mg、Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | Cl2O | ClO2 | Cl2O7 |
| 沸点/℃ | 3.8 | 11.0 | 82.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中含有Na+、Cl-,所以NaCl晶体能导电 | |
| B. | CO2溶于水能导电,所以CO2是电解质 | |
| C. | BaSO4难溶于水,BaSO4是非电解质 | |
| D. | Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
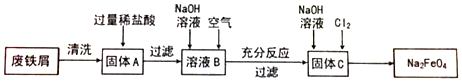
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤①、③的操作都是过滤 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是精馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 min内,Y的平均反应速率为0.03 mol•L-1•s-1 | |
| B. | 10 min内,X和Y反应放出的热量为a kJ | |
| C. | 10 min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10 min内,前5minX的平均反应速率与后5minX的平均反应速率相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com