

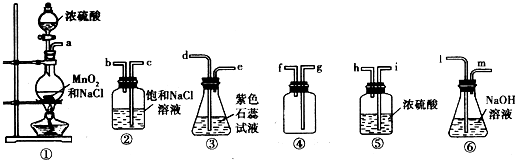
 Na2SO4+MnSO4+Cl2↑+2H20;为了完成实验(3)、(4),仪器连接顺序为发生装置-净化装置-氯气与石蕊作用-干燥-收集氯气(与铜反应)-尾气吸收(继续做试验证明氧气);氯气通入石蕊先变红后褪色,如果继续通氯气,则溶液变为黄绿色.氯气与铜反应生成棕黄色烟,不生成固体熔融物,不用铺细沙.信息给出浓硫酸能与二氧化锰反应生成氧气,反应方程式可根据电子守恒写出:2Mn02+2H2SO4(浓)
Na2SO4+MnSO4+Cl2↑+2H20;为了完成实验(3)、(4),仪器连接顺序为发生装置-净化装置-氯气与石蕊作用-干燥-收集氯气(与铜反应)-尾气吸收(继续做试验证明氧气);氯气通入石蕊先变红后褪色,如果继续通氯气,则溶液变为黄绿色.氯气与铜反应生成棕黄色烟,不生成固体熔融物,不用铺细沙.信息给出浓硫酸能与二氧化锰反应生成氧气,反应方程式可根据电子守恒写出:2Mn02+2H2SO4(浓) 2MnSO4+O2↑+2H20;
2MnSO4+O2↑+2H20; 2MnSO4+O2↑+2H20;
2MnSO4+O2↑+2H20; 2MnSO4+O2↑+2H20;
2MnSO4+O2↑+2H20;

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:

| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
| ||
| ||
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式: 。
 (3)充分反应后,若A试管中有铜片剩余,继续向A中加入
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入
NaNO3,发现铜片溶解,反应的离子方程式
为 。
(4)充分反应后,若A试管中无铜片剩余,
但出现白色混浊,该白色固体是 ,
初步确认该白色固体是什么物质的实验操作方法
是 。
(5)B试管口的棉花应沾有的试剂是 。
(6)小组成员向(4)反应后的溶液中加入足量的氧化铜。使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量四次,最后两次称量的目的是
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.0g | 37.8g | 27.0g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”、“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com