

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
分析 (1)石英砂的主要成分是SiO2;反应器甲中SiO2与C在高温下发生反应生成Si和CO;
(2)碳化硅又称金刚砂,其熔点高硬度大,属于原子晶体;
(3)①根据外界条件对速率、平衡的影响;
②根据题中数据,采用精馏(或蒸馏)方法提纯SiHCl3;
③SiHCl3水解生成硅酸、氢气和氯化氢;
(4)反应器丙中为氢气还原SiHCl3生成Si和HCl;
(5)根据反应物中和生成物中都有的物质考虑可以循环使用的物质.
解答 解:(1)石英砂的主要成分是SiO2;反应器甲中SiO2与C在高温下发生反应生成Si和CO,方程式为:SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑,
故答案为:SiO2; SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑;
(2)碳化硅又称金刚砂,其熔点高硬度大,属于原子晶体,故答案为:金刚砂;原子晶体;
(3)①用催化剂、增大压强或HCl浓度,加快SiHCl3的生成速率而又不降低硅的转化率提高,
故答案为:催化剂、增大压强或HCl浓度;
②根据题中数据,利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.9℃),由于沸点差别较大,可以通过精馏除去杂质,所以提纯SiHCl3的主要工艺操作依次为沉降、冷凝、精馏,其中精馏温度最好控制在31.8℃,
故答案为:沉降;精馏;精馏;31.8℃;
③SiHCl3水解反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,故答案为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
(4)反应器丙中为氢气还原SiHCl3生成Si和HCl,方程式为:H2+SiHCl3 $\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl,故答案为:H2+SiHCl3 $\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl;
(5)由图示可知反应物有粗硅、HCl、H2;反应过程中生成物有:SiHCl3、H2、SiCl4、HCl,所以在反应物中和生成物中都有的物质是HCl、H2,所以流程中可循环使用的物质是HCl、H2,故答案为:氯化氢、氢气.
点评 本题结合提纯粗硅的工艺流程考查了外界条件对平衡的影响、物质的分离、方程式的书写等,难度较大,考查学生分析和解决问题的能力.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题

 ,C中官能团的名称为 羧基.
,C中官能团的名称为 羧基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
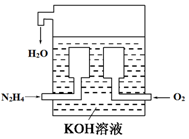
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯的分子式为:CH3CH=CH2 | B. | H2O2的电子式为: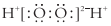 | ||
| C. | S2-的离子结构示意图为: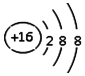 | D. | 苯的比例模型为: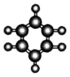 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6KJ•mol-1 | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 镉元素属于重金属元素,食用‘镉大米’会影响骨骼和肾脏 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴、阳离子的个数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与稀HNO3反应:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com