
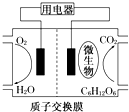
| A. | 该电池不能够在高温下工作 | |
| B. | 电池的负极反应:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| C. | 放电过程中,H+会从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体$\frac{22.4}{6}$ L |
分析 A、从蛋白质的性质:高温下会变性分析;
C.原电池内部阳离子向正极移动;
B.原电池负极发生失电子的氧化反应,据此书写电极反应;
D.根据正负极电极反应式结合电子守恒进行计算.
解答 解:A、高温条件下微生物会变性,该电池不能够在高温下工作,故A正确;
B、负极是葡萄糖失电子生成二氧化碳,电极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+,故B正确;
C、原电池内部阳离子应向正极移动,则,H+会从负极区向正极区迁移,故C正确;
D、正极反应式为O2+4e-+4H+═2H2O,对比负极反应可知,消耗1mol氧气生成1mol二氧化碳,标准状况下体积是22.4L,故D错误;
故选D.
点评 本题考查了原电池原理、电极方程式的书写、离子的移动方向,有关化学方程式的计算,有关气体体积的计算要注意温度和压强,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应:Fe-2e-═Fe2+ | |
| B. | 阴极反应:2H++2e-═H2↑ | |
| C. | 在电解过程中工业废水由酸性变为碱性 | |
| D. | 可以将铁电极改为石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
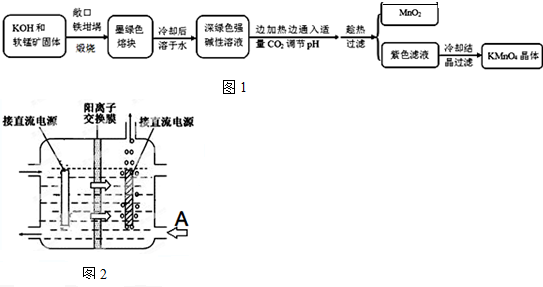
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金的熔点介于钠、铝之间 | |
| B. | 钠或铝形成的氧化物均为碱性氧化物 | |
| C. | 等质量钠和铝分别与足量的盐酸反应钠产生的气体多 | |
| D. | 若合金中n(Na)=n(Al),将其投入到足量的水中,可得无色透明溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有CO32- | B. | 一定含有Ag+ | ||
| C. | 一定含有SO42- | D. | 可能含有SO42-也可能含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com