

| A. | 装置①:制取乙炔并验证炔烃的性质;溴水褪色 | |
| B. | 装置②:检验乙醇的氧化性;溶液颜色从绿色变成橙色 | |
| C. | 装置③:验证葡萄糖分子中含有醛基官能团;出现银镜 | |
| D. | 装置④:验证碳酸的酸性比苯酚的酸性强;溶液变浑浊 |
分析 A.生成的乙炔气体中混有的硫化氢也能使溴水褪色;
B.乙醇被氧化,橙色溶液变成绿色;
C.葡萄糖含-CHO,发生银镜反应;
D.挥发出的HCl能够使苯酚钠溶液反应,干扰了检验结果.
解答 解:A.生成的乙炔气体中混有硫化氢,均与溴水反应,不能验证乙炔的性质,故A错误;
B.乙醇被氧化,橙色溶液变成绿色,检验乙醇的还原性,故B错误;
C.葡萄糖含-CHO,发生银镜反应,则图中出现银镜,可知葡萄糖分子中含有醛基官能团,故C正确;
D.盐酸易挥发,挥发出来的氯化氢气体能够使苯酚钠溶液变浑浊,干扰了检验,可用稀硫酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的性质及制备等,把握有机物官能团与性质的关系、制备实验、反应原理为解答的关键,注重基础知识的考查,选项B为易错点,题目难度不大.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 若c=32(a+b),则b=2a | B. | 若c<32(a+b),则a>2b | ||
| C. | 若a<2b,则c=48a | D. | 若a>2b,则32(a+b)>c>96b |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极 | B. | 电子从锌极流出 | ||
| C. | 锌极发生氧化反应 | D. | 电解液肯定不是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L 的硫酸铵溶液中:c(NH4+)>c(SO42?)>c(H+)>c(OH?) | |
| B. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(OH?)+c(HCO3?)+2c(H2CO3) | |
| C. | pH之和为14的H2C2O4与KOH 溶液混合:c(K+)>c(H+)>c(OH?)>c(HC2O4?) | |
| D. | pH=5 的H2S溶液中,c(H+)>c(HS?)=1×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
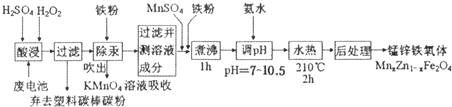
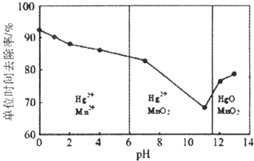
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{8b-3a}{2v}$mol/L | B. | $\frac{8b-3a}{4v}$mol/L | C. | $\frac{8b-3a}{v}$mol/L | D. | $\frac{a-2b}{2v}$mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com