
【题目】化合物F(盐酸地拉普利)是一种治疗高血压的药物,其合成路线流程图如图:
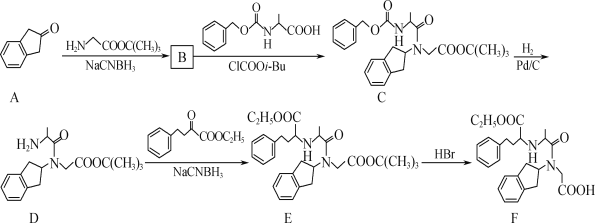
(1)D中的官能团有酰胺键、__和__(填名称)。
(2)E→F的反应类型为__。
(3)B的分子式为C15H21O2N,写出B的结构简式:__。
(4)A的一种同分异构体M同时满足下列条件,写出M的结构简式:___。
①M是一种芳香族化合物,能与NaOH溶液发生反应;
②M分子中有4种不同化学环境的氢。
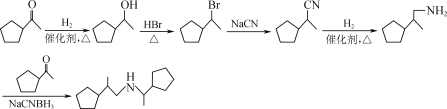
(5)已知:R—X![]() R—CN
R—CN![]() R—CH2NH2。
R—CH2NH2。
写出以![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)___。
【答案】氨基 酯基 取代反应 ![]()
![]()
【解析】
B的分子式为C15H21O2N,对比B生成C的另一反应物和C的结构变化可知,B中含有氨基,发生成肽反应生成C,再结合A和A生成B的反应物可知B为![]() ,A发生取代反应生成B,C发生还原反应生成D,D发生取代反应生成E,E发生取代反应生成F。
,A发生取代反应生成B,C发生还原反应生成D,D发生取代反应生成E,E发生取代反应生成F。
(1)根据D的结构简式可知D的官能团为酰胺键、酯基、氨基;
(2)对比E和F的结构变化可知该反应为取代反应;
(3)根据分析可知B为![]() ;
;
(4)A的分子式为C9H8O,同分异构体M满足:
①M是一种芳香族化合物,能与NaOH溶液发生反应,说明含有苯环和酚羟基,则还剩余-C3H3,则苯环的侧链上含有三键或双键+环;
②M分子中有4种不同化学环境的氢,说明结构对称,苯环上应有2个处于对位的取代基,则M的结构为![]() ;
;
(5)对比![]() 和
和![]() 的结构可知需要
的结构可知需要![]() 与
与![]() 发生类似D到E的反应,结合题目所给信息可知
发生类似D到E的反应,结合题目所给信息可知![]() 可先于氢气加成,在于卤化氢取代得到形如R-X的结构,之后再经过题目给的转化可得
可先于氢气加成,在于卤化氢取代得到形如R-X的结构,之后再经过题目给的转化可得![]() ,所以合成路线为:
,所以合成路线为: 。
。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二醇、LiPF6、LiAsF6和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Fe的价层电子排布式为___。
(2)Li、F、P、As四种元素的电负性由大到小的顺序为___。
(3)乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是___。
(4)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
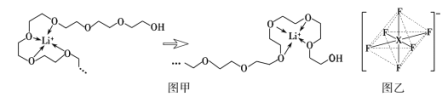
①聚乙二醇分子中,碳、氧的杂化类型分别是___、___。
②从化学键角度看,Li+迁移过程发生___(填“物理变化”或“化学变化”)。
③PF6中P的配位数为___。
④相同条件,Li+在___(填“LiPF6”或“LiAsF6”)中迁移较快,原因是___。
(5)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的品胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为___g·cm-3(列出计算表达式)。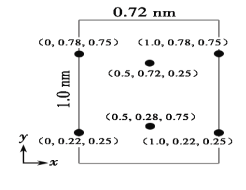
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈____色,具有_____光泽,但断面很快变___________,主要是由于生成一薄层_______。若把钠放在石棉网上加热,可观察到的现象是_______________ ,反应的化学方程式为_______其中还原剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,部分反应物或生成物已略去。试根据图中转化关系,回答下列问题。
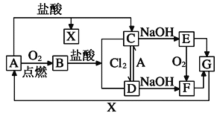
(1)B的俗名为____。
(2)保存C溶液时需加入少量A的原因是____,A与水蒸气反应的化学方程式为____,该反应类型属于____(填基本反应类型)
(3)E生成F可观察到的现象____,化学方程式为____。
(4)写出B→C化学方程式为____,C→D的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家孙予罕等发现,以泡沫镍[3 NiO/Ni(3 表示 NiO 在泡沫镍中的质量百分数)] 作为基材上的催化剂可实现将烷烃直接电催化转化为醇类(转化示意图如图所示)。下列说法正确的是
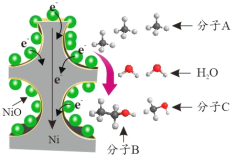
A.22.4 L A 中质子数为 10 mol
B.1mol C 中共价键数目为 4 mol
C.生成 1 mol Ni 可还原出 1 mol B
D.11.8 g 泡沫镍含 Ni 单质 0.194 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把18.4g由NaOH和NaHCO3组成的固体混合物在密闭容器中加热到约250摄氏度, 经充分反应后排出气体,冷却后称得固体质量为16.6g,试确定原混合物中NaOH与NaHCO3的物质的量的关系为( )
A.NaOH<NaHCO3B.NaOH>NaHCO3
C.NaOH=NaHCO3D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国矿石种类很多,如黄铜矿、煤、锰矿、锑锌矿等,请回答下列问题:
(l)黄铜矿的主要成分为二硫化亚铁铜(CuFeS2),基态Cu2+的外围电子排布图为 ______,Fe2+含有 ___个未成对电子。
(2)Mn的第三电离能比Fe的第三电离能大的原因为 ___。
(3)煤化工可得氨气、苯、甲苯等产品,氨的空间构型为 ___,甲苯分子上甲基的碳原子的杂化方式为____;氨硼烷化合物(NH3BH3)是一种新型化学氢化物储氢材料,氨硼烷的结构式为____(配位键用“→”表示),与氨硼烷互为等电子体的有机小分子为_____写名称)。
(4)碲化锌的晶胞结构如图1所示。
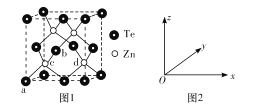
①碲化锌的化学式为____。
②图2可表示晶胞内部各原子的相对位置,已知a、b、c的原子坐标参数分别为(0,0,0)、(![]() ,0,
,0,![]() )、(
)、(![]() ,
,![]() ,
,![]() ),则d的原子坐标参数为____
),则d的原子坐标参数为____
③若两个距离最近的Te原子间距离为apm,阿伏加德罗常数值为NA,则晶体密度为____g/cm3(用含有NA、a的代数式表示,不必化简)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com