
| A. | 镁条溶于盐酸是吸热反应 | B. | 中和反应是吸热反应 | ||
| C. | 铝热反应属于吸热反应 | D. | 碳酸钙分解是吸热反应 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:实验题
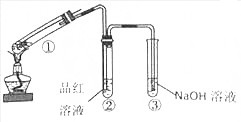
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量 | B. | 摩尔质量 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式相同的不同物质一定属于同系物 | |
| B. | 完全燃烧某有机物,生成CO2和H2O的物质的量之比为1:1,该有机物只可能是烯烃或环烷烃 | |
| C. | 分子式相同而结构不同的化合物一定互为同分异构体 | |
| D. | 符合通式CnH2n-2的有机物一定是炔烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②⑤①③④ | C. | ①③⑤②④ | D. | ②①③⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
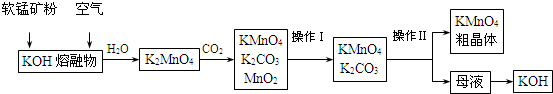
| 实验方法 | 实验现象及结论 |
| 取少量待测物于试管中,加水溶解后,滴加少量稀硫酸 | 出现无色气体溢出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com