
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
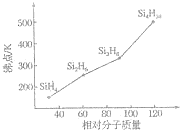 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Fe+2HCl═H2↑+FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 汽车尾气是导致酸雨的原因之一 | B. | 酸雨会使土壤、湖泊酸化 | ||
| C. | 酸雨形成中不涉及氧化还原反应 | D. | 燃煤中加入石灰石可防治酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 编号 | 溶液X | 实验现象 |
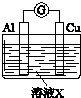 | 实验Ⅰ | 6mol•L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色. |
| 实验Ⅱ | 15mol•L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色. |
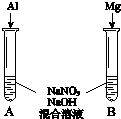 (3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.
(3)用如图装置进行实验Ⅲ:溶液X为1mol•L-1稀硝酸溶液,观察到电流计指针向右偏转.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
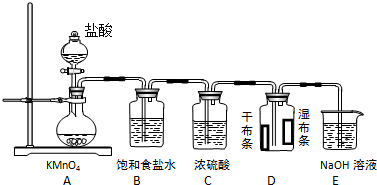
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 实验操作 | 实验现象 |
| 实验1 | 向2mL 0.001mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 无明显变化.用激光笔照射,没有出现光亮的通路. |
| 实验2 | 向2mL 0.1mol/L NaHCO3溶液中加入1mL 0.1mol/LCaCl2溶液 | 略显白色均匀的浑浊,用激光笔照射,出现光亮的通路. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
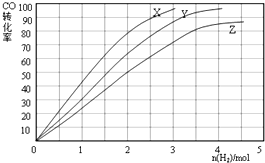
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com