
【题目】在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g) ![]() 2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
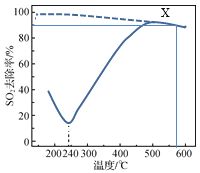
A.该反应的ΔH>0
B.180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
【答案】B
【解析】
A.由虚线可知,温度升高,SO2的平衡去除率减小,则温度升高,平衡逆向移动,逆反应为吸热反应,则该反应的ΔH<0,A错误;
B.从图上看,500℃SO2去除率最高,说明500℃催化剂活性最好,500℃以下,温度升高催化剂活性增强,SO2去除率应该增大,但是180℃到240℃SO2去除率减小,结合题中催化剂为疏松多孔可知,180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附,180℃到240℃,SO2去除率减小的主要原因是随着温度升高,γAl2O3吸附SO2的量减小,B正确;
C.由图可知,500℃,SO2去除率为平衡去除率,换高效催化剂不能使平衡发生移动,SO2去除率不变,C错误;
D.设CO、SO2起始物质的量浓度分别为a mol·L-1、b mol·L-1,体积为1L,则 ,X点对应的平衡常数K=
,X点对应的平衡常数K=![]() ,恒容下再通入CO、CO2各0.1 mol,则Qc=
,恒容下再通入CO、CO2各0.1 mol,则Qc=![]() ,很显然,Qc和K的关系和CO、SO2起始a、b的关系有关,若1.8b+0.1>a-1.8b+0.1,即3.6b>a时,Qc>K,平衡逆向移动,v(正)<v(逆),3.6b=a时,Qc=K,平衡不移动,v(正)=v(逆),3.6b<a时,Qc<K,平衡正向移动,v(正)>v(逆),D错误。
,很显然,Qc和K的关系和CO、SO2起始a、b的关系有关,若1.8b+0.1>a-1.8b+0.1,即3.6b>a时,Qc>K,平衡逆向移动,v(正)<v(逆),3.6b=a时,Qc=K,平衡不移动,v(正)=v(逆),3.6b<a时,Qc<K,平衡正向移动,v(正)>v(逆),D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合溶液中加入足量的铜粉,从离子反应的角度分析,则最多能溶解铜粉的质量为( )
A. 9.6gB. 6.4 gC. 3.2 gD. 2.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O===Na++2OH-+H2↑
B.铁与水蒸气反应:Fe + 3H2O == Fe(OH)3 + 3H2↑
C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H2↑
D.铁与稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaNO3![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
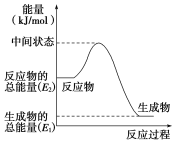
(3)H2(g)的燃烧热为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
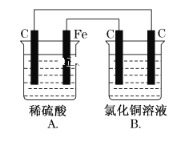
A.A为原电池
B.B为电解池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com