
��14�֣�ijʵ��С��������ͼ��ʾʵ��װ�ã�ʹ����ƽ����ͨ��װ�н����Ƶ�Ӳ�ʲ�������ȡ�⻯�ƣ���������Ʒ�ijɷּ����ȡ�
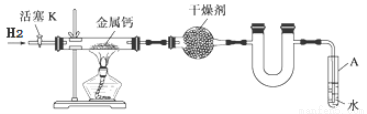
��1���Թ�A�������� �� ��
��2���뽫�����Ʊ��⻯�ƵIJ������貹��������
�ٴ���Kͨ��H2��
�� ��
�۵�ȼ�ƾ��ƣ����з�Ӧ��
�ܷ�Ӧ������ ��
�ݲ��װ�ã�ȡ�����
��3������������Ʒ��ֻ���ơ�������Ԫ�ء�ȡ������Ʒ��С�ļ���ˮ�У��۲쵽������ð��������һ�η�̪��Һ����Һ��졣��Ӧ�Ļ�ѧ����ʽ������CaH2+2H2O=Ca(OH)2+2H2���� ��
��4��ȡ2.30 g��Ʒ��������ˮ�����500 mL��Һ��ȡ25.00 mL����Һ����ƿ�У�����2�η�̪��Һ����0.2500 mol/L ����ζ�������ƽ��ʵ�飬ƽ����������22.00 mL��
��������Һ���õIJ��������н�ͷ�ιܡ��ձ�������������Ͳ�� ��
���жϵζ��յ�ķ����� ��
�۲�Ʒ�����ֳɷ����ʵ���֮��Ϊ ��
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡ�����и�����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
(12��)��ѡ���⣩�������A��B��С�⣬��ѡ������һС�Ⲣ��������������AС�����֡�
A��[���ʽṹ������]
����(H2NCONH2)��һ��ũҵ�����г��õĵ��ʡ��ڹ�ҵ�ϣ����ػ����������л����ʣ���[Fe(H2NCONH2)6](NO3)3[�����������غ���(��)]��
��1����̬Fe3���ĺ�������Ų�ʽΪ________��
��2��C��N��O����Ԫ�صĵ�һ��������С�����˳����________��
��3���������������(Fe(CN) )�е�����CN����Cԭ�ӵ��ӻ����������________��д��һ����CN����Ϊ�ȵ�����ĵ��ʷ��ӵĽṹʽ________��
)�е�����CN����Cԭ�ӵ��ӻ����������________��д��һ����CN����Ϊ�ȵ�����ĵ��ʷ��ӵĽṹʽ________��
��4����һ�������£�NH3��CO2�ܺϳ����أ�1 mol���ط����У��Ҽ�����ĿΪ________��
��5���������ľ����ڲ�ͬ�¶��������ֶѻ���ʽ�������ֱ���ͼ��ʾ������������������������������ʵ�ʺ��е���ԭ�Ӹ���֮��Ϊ________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ�������и�һ��ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���SO2��˵���У�����ȷ����
A��SO2��������Ư��ʳƷ
B��SO2��ˮ��Ӧ����H2SO4
C��SO2����Ư���ԣ�����ʹƷ����Һ��ɫ
D��SO2��һ�ִ�����Ⱦ�����Ҫ�����ڻ�ʯȼ�ϵ�ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ�������и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��Ȼ��ȡ���˹��ϳɵ��л��������ǻ����,�������һ���л��������������о�,һ��Ҫ��ȡ�ļ���������
A�����롢�ᴿ��ȷ������ʽ��ȷ��ʵ��ʽ��ȷ���ṹʽ
B�����롢�ᴿ��ȷ��ʵ��ʽ��ȷ������ʽ��ȷ���ṹʽ
C�����롢�ᴿ��ȷ���ṹʽ��ȷ��ʵ��ʽ��ȷ������ʽ
D��ȷ������ʽ��ȷ��ʵ��ʽ��ȷ���ṹʽ�����롢�ᴿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015������ʡ�������и߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������������������
A��Na2CO3 B��CaC2 C��CH4 D��CO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��Ҵ�и�����������Ͽ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij����С���ͬѧ��ij�ؿ����ɼ����л������������Ʒ��Ȼ��������ˮ��ȡ����̽���������������Գɷֵ�ʵ���У����и���ʵ������ó��Ľ��۲���ȷ����
A�����ȡҺ�е���AgNO3��Һ�а�ɫ����������˵�������п��ܺ���Cl-
B�����ȡҺ�е��������ữ��BaCl2��Һ���а�ɫ����������˵��������һ����SO42-
C�����ȡҺ�м���Cu��ŨH2SO4���Թܿ��к���ɫ���������˵�������п��ܺ���NO3-
D�����ȡҺ�м���ŨNaOH��Һ�ȣ��Թܿڸ���ʪ��ĺ�ɫʯ����ֽ������˵��������һ������NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���ʮУ���������ۺϻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
����10�֣���ϩ��һ����;�㷺�Ļ����л�����ԭ�ϣ����������ϳ�̼���������DMC������Ҫ������Ʒ�����ַ�Ӧ��������ȥ����
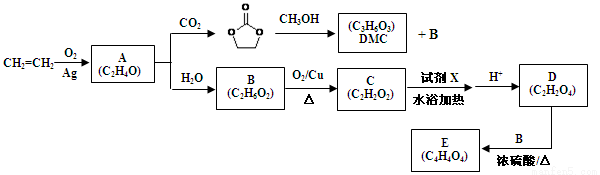
��֪����1���ǻ�ֱ����̼̼˫���������ȶ���R��CH=CH��OH��R��CH2��CHO
��2��1mol������C������������Һ��Ӧ����4mol������
��1����ҵ��������ϩ����Ҫ������ ���Լ�XΪ ��
��2������˵����ȷ���� ��
A��D��E�ķ�Ӧ����Ϊȡ����Ӧ
B��������A�뻯����C������ͬ������
C��DMC������������Ϊͬϵ��
D��DMC����������ˮ���ܲ���CO2�ͼ״�
��3��д��B��C�Ļ�ѧ��Ӧ����ʽ ��
��4���ִ���ҵҲ�������أ� ���ͼ״��ڴ��������������£�����ȡ����Ӧ����DMC����д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ ��
���ͼ״��ڴ��������������£�����ȡ����Ӧ����DMC����д���÷�Ӧ�Ļ�ѧ��Ӧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�꽭��ʡЭ���������ѧ�����������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�л�����ҩ���������м��壬��ṹ��ʽ��ͼ�������й���������ȷ����
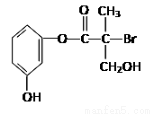
A�����л�����Ũ��ˮ�ɷ���ȡ����Ӧ
B��1 mol���л���������NaOH��Һ��Ӧ�������4 mol NaOH
C�����л�����Ũ�����Ϲ��ȿɷ�����ȥ��Ӧ
D�����л��ᆳ��������������������ͭ����Һ��������ש��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ɽ��ʡԭƽ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й��Ȼ�ѧ����ʽ��������ȷ����
A����20.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7kJ����������ϡ�����ϡNaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ��NaOH(aq) + CH3COOH(aq) = CH3COONa(aq) + H2O(l)����H = ��57.4kJ��mol-1
B����֪C��ʯī��s��= C�����ʯ��s������H>0����ʯī�Ƚ��ʯ�ȶ�
C����֪��Ӧ2H2(g) + O2(g) = 2H2O(l)����H=��571.6kJ��mol-1����H2��ȼ����Ϊ571.6kJ��mol-1
D����֪2C(s)+2O2(g)=2CO2(g) ��H1��2C(s)+O2(g)=2CO(g)��H2�����H1>��H2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com