

 ;
;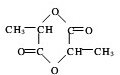 ;
;分析 (1)乳酸的结构为: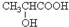 ,其中羧基和羟基都能与钠反应产生氢气;
,其中羧基和羟基都能与钠反应产生氢气;
(2)如果乳酸分子内脱水的生成物与溴水发生反应,则乳酸中羟基与邻位碳上的氢脱水生成碳碳双键,再与溴发生加成反应;
(3)两分子相互反应生成为酯环,即分子发生酯化反应;
(4)由丙烯合成乳酸,可以先将丙烯与溴发生加成反应生成1,2-二溴丙烷,再在碱性条件下水解得1,2-二溴丙二醇,再经过两步氧化可得CH3COCOOH,再将CH3COCOOH与氢气加成可得乳酸,据此答题.
解答 解:(1)金属钠与醇、羧酸都能发生反应,置换出氢气,反应方程式为 ,
,
故答案为: ;
;
(2)如果乳酸分子内脱水的生成物与溴水发生反应,则乳酸中羟基与邻位碳上的氢脱水生成碳碳双键,其结构为CH2=CHCOOH,再与溴发生加成反应,得产物为CH2BrCHBrCOOH,
故答案为:CH2BrCHBrCOOH;
(3)乳酸的结构简式为CH3CH(OH)COOH,2个乳酸分子在一定条件下可发生酯化反应生成六元环状化合物,反应方程式为:2CH3CH(OH)COOH$\stackrel{催化剂}{→}$ +2H2O,
+2H2O,
故答案为: ;
;
(4)由丙烯合成乳酸,可以先将丙烯与溴发生加成反应生成1,2-二溴丙烷,再在碱性条件下水解得1,2-二溴丙二醇,再经过两步氧化可得CH3COCOOH,再将CH3COCOOH与氢气加成可得乳酸,所以需要经过的反应为加成、水解、氧化、氧化、还原(加氢),
故答案为:加成、水解、氧化、氧化、还原(加氢).
点评 本题以乳酸的结构为载体,考查官能团的性质,题目难度不大,熟悉常见官能团的性质,进行知识迁移运用即可解答,侧重醇、羧酸性质的考查.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ①②⑦⑨ | C. | ③⑤⑥⑩ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
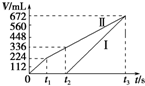 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: | |
| B. | ${\;}_{17}^{35}$Cl- 与${\;}_{17}^{37}$Cl属同位素 | |
| C. | 单质气体分子中不一定都具有共价键 | |
| D. | CaCl2晶体中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com