
| A. | HCl受热不分解,H2S受热分解 | |
| B. | 往H2S溶液中通入氯气,生成硫和氯化氢 | |
| C. | 与Cu化合时,硫显-2价,氯显-1价 | |
| D. | Cl、S原子的电子层数相同,且Cl原子半径比S原子半径小 |
分析 元素非金属性强弱可从最高价氧化物对应水化物的酸性强弱、氢化物的热稳定性、得电子能力强弱、非金属间置换反应等来做出判断.
解答 解:A、HCl比H2S稳定,说明氯原子比硫原子更易结合氢原子,即氯的非金属性比硫强,故A正确;
B、Cl2能与H2S反应生成S,即Cl2+H2S=S↓+2HCl,说明Cl2的氧化性比S的氧化性强,即Cl夺取电子的能力比S强,非金属性:Cl>S,故B正确;
C、与Cu化合时,硫显-2价,氯显-1价,说明S的还原性更强,氯气的氧化性更强,则非金属性氯大于硫,故C正确;
D、非金属性强弱与原子半径大小没有必然联系,故D错误;
故选D.
点评 本题把能用于判断元素非金属性强弱的因素与不能用于判断元素非金属性强弱的因素结合起来,具有很强的迷惑性,因此,牢固掌握、理解基本知识是解决这类题目的重中之重.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 41.8 g固体物质为Na2CO3 | |
| B. | 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物 | |
| C. | 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物 | |
| D. | 一定量的Na2O2为78 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、SO32-、I-、Ca2+ | B. | Ca2+、I-、MnO4-、SO32- | ||
| C. | Ca2+、CO32-、I-、SO32- | D. | NH4+、Br-、CO32-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
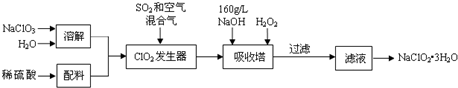
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
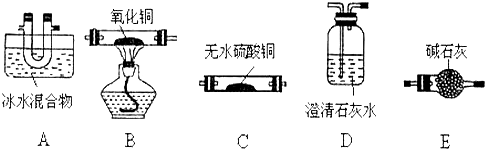
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com