��������1���ٸ�����Ŀ���ݿ�֪���ù�ҵ������ȡ�״�Ϊ������̼��������Ӧ���ɼ״���ˮ����������ʽ�������Ӧ��������ֵ�Ũ�ȱ仯����ƽ��ʱ��Ũ�ȣ�����v=
�����v��H
2����
��CO
2��ת��������ƽ�������ƶ�������Ӱ��ƽ���ƶ���������ؿ������жϣ�
��2���ٸ����¶��뻯ѧƽ�ⳣ���Ĺ�ϵȷ����Ӧ�ȣ�
���¶�Խ�ߣ���Ӧ����Խ��Ӧʱ��Խ�̣�
�۸÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ���¶���ͬ����ѧƽ�ⳣ����ͬ����Ӧ���ת������ͬ��
�ܸ��ݻ�ѧƽ�ⳣ����Ũ���̵���Դ�С�жϷ�Ӧ�������Ũ����С��ƽ�ⳣ������ƽ��������Ӧ������У�
���
�⣺��1���ٸù�ҵ������ȡ�״�ԭ��Ϊ������̼��������Ӧ���ɼ״���ˮ����Ӧ����ʽΪCO
2��g��+3H
2��g��

CH
3OH��g��+H
2O��g������������ʽ��֪��
CO
2��g��+3H
2��g��

CH
3OH��g��+H
2O��g��
��ʼ��mol����1 3.25 0 0
�仯��mol����0.5 1.5 0.5 0.5
3minʱ��mol����0.5 1.75 0.5 0.5
�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H
2��=
=0.25mol/��L��min��
�ʴ�Ϊ��CO
2+3H
2
CH
3OH+H
2O�� 0.25 mol?L
-1?min
-1��
��CO
2��ת��������ƽ�������ƶ�����
A����ԭ�������ٳ���1mol H
2��ƽ�������ƶ���CO
2��ת��������A��ȷ��
B����ԭ�������ٳ���1mol CO
2��CO
2�������ʵ��������ӣ���Ȼƽ���������ƶ���������������ԭ����֪��CO
2��ת���ʼ�С����B����
C����С�������ݻ����൱�ڼ�ѹ�����ڸ÷�Ӧ�����������С�ķ�Ӧ������ƽ�������ƶ���CO
2��ת��������C��ȷ��
D��ʹ�ø���Ч�Ĵ������Ի�ѧƽ����ƶ�û��Ӱ�죬��D����
E����ˮ��������ϵ�з��������С������Ũ�ȣ�ƽ�������ƶ���CO
2��ת��������E��ȷ��
�ʴ�Ϊ��ACE��
��2������������ƽ��ʱc��CH
3OCH
3��=c��H
2O��=
=0.080mol/L��c��CH
3OH��=
=0.04mol/L���������л�ѧƽ�ⳣ��K
1=
=4����������ƽ��ʱc��CH
3OCH
3��=c��H
2O��=
=0.090mol/L��c��CH
3OH��=
=0.02mol/L����ѧƽ�ⳣ��K
2=
=20.25��4�����Խ����¶ȣ���ѧƽ�ⳣ������Ӧ������Ӧ�����ƶ���������Ӧ�Ƿ��ȷ�Ӧ������aС��0���ʴ�Ϊ��С�ڣ�
���������е��¶ȱ���������¶ȸߣ��¶�Խ�߷�Ӧ����Խ�죬�ﵽ������ʱ��Խ�̣��ʴ�Ϊ��С�ڣ�
�ۺ��������£��������൱����������Ļ����ϼ�ѹ�������ڸ÷�Ӧ�Ƿ�Ӧǰ�������������ķ�Ӧ�����ƽ�ⲻ�ƶ��������������е�CH
3OH����������������е���ȣ��ʴ�Ϊ�����ڣ�
��c��CH
3OH��=0.1mol/L��c��CH
3OCH
3 ��=0.15mol/L��c��H
2O��=0.10mol/L��Ũ����=
=1.5��4��ƽ��������Ӧ�����ƶ����ʴ�Ϊ������Ӧ����

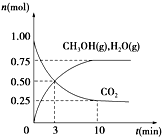 ��1����ѧ����H2��CO2�����״�ȼ�ϣ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2L���ܱ������г���1mol CO2��3.25mol H2����һ�������·�Ӧ�����CO2��CH3OH��g����H2O��g�������ʵ�����n����ʱ��ı仯��ϵ��ͼ��ʾ��
��1����ѧ����H2��CO2�����״�ȼ�ϣ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2L���ܱ������г���1mol CO2��3.25mol H2����һ�������·�Ӧ�����CO2��CH3OH��g����H2O��g�������ʵ�����n����ʱ��ı仯��ϵ��ͼ��ʾ�� CH3OH��g��+H2O��g������������ʽ��֪��
CH3OH��g��+H2O��g������������ʽ��֪�� CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g�� CH3OH+H2O�� 0.25 mol?L-1?min-1��
CH3OH+H2O�� 0.25 mol?L-1?min-1��



