
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。
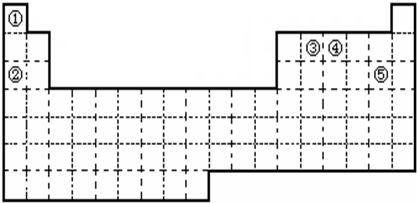
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | | | | | | | ⑩ |
| 2 | | | | | ⑥ | | ⑦ | |
| 3 | ② | ③ | ④ | | | | ⑧ | |
| 4 | ⑤ | | | | | | ⑨ | |
(1) He
(2) NaOH
(3) K>Na>H 处于同一主族,同一主族从上到下原子半径逐渐增大
(4) NH3 碱
(5) 黄
(6) Al 2Al+2OH-+2H2O===2AlO2-+3H2↑
解析试题分析:(1)最不活泼的元素找稀有气体元素,就是⑩,He;(2)②、③、④三种元素的氧化物对应的水化物为金属元素最高价氧化物对应的水化物,则金属性最强的,碱性就最强,所以为NaOH。(3)比较原子半径时,同主族元素从上到下原子半径逐渐增大。(4)⑥为第二周期,ⅤA族,则为氮元素,氢化物为氨气,水溶液呈碱性。(5)②为第三周期ⅠA族,为钠元素,⑧号为氯元素,则化合物为氯化钠,焰色反应为黄色。(6)既可以与酸反应又可以与碱反应的单质只有铝。
考点:元素周期表,元素周期律
点评:本题需要根据元素所处的位置把元素推断出来,然后根据元素周期律中位、构、性的关系,利用元素周期律来解题。本题属于常规题型,学生对于此类题目应该熟练掌握。


科目:高中化学 来源: 题型:
| ||
| ||




| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表是元素周期表的一部分,请依据该表回答问题.查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负
价的绝对值相等,又可反氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
(B)

(1)在上面元素周期表中全部是金属元素的区域为
(a) A (b) B
(c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com