
| A. | ${\;}_{55}^{\;}$Br的电子排布式可简写为[Ar]4s24p5 | |
| B. | 16O与18O互为同位素,H216O、H218O互为同素异形体 | |
| C. | CH4、NH${\;}_{4}^{+}$粒子的空间构型均为正四面体形 | |
| D. | NH4Cl的电子式为 |
分析 A.35Br的电子排布式为1s22s22p63s23p63d104s24p5;
B.同素异形体的研究对象为单质,H216O、H218O不是单质;
C.CH4、NH4+中心原子为sp3杂化;
D.NH4Cl的电子式中氯离子没有标出最外层电子.
解答 解:A.35Br的电子排布式为1s22s22p63s23p63d104s24p5,则35Br的电子排布式可简写为[Ar]3d104s24p5,故A错误;
B.16O与18O为同种元素的不同原子,互为同位素;H216O、H218O为水,属于同一种物质,不是同素异形体,故B错误;
C.在常见的化合物中CH4、NH4+中心原子为sp3杂化,为正四面体结构,故C正确;
D.NH4Cl为离子化合物,阴阳离子需要标出所带电荷,铵根离子和氯离子还应该标出最外层电子,氯化铵正确的电子式为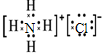 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、同素异形体、同位素、电子排布式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | Zn极为负极,其电极反应为:Zn+2OH--2e-═ZnO+H2O | |
| B. | Ag2O极为负极,其电极反应为:Ag2O+H2O-2e-═2Ag+2OH- | |
| C. | 电池放电过程中,负极周围溶液的pH不断增大 | |
| D. | 该电池用完后,可作为普通垃圾处理,因为它不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题






 $→_{AlCl_{3}}^{CH_{3}COCl}$
$→_{AlCl_{3}}^{CH_{3}COCl}$  ,CH3COOH$\stackrel{SOCl_{2}}{→}$
,CH3COOH$\stackrel{SOCl_{2}}{→}$ 
 为原料合成
为原料合成 单体的路线流程图(无机试剂任选)
单体的路线流程图(无机试剂任选)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com