
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
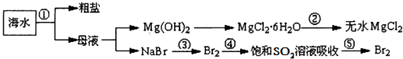
| A、第②步是MgCl2?6H2O在坩埚中加强热分解 |
| B、第①步是海水蒸发浓缩、结晶过滤 |
| C、第③、⑤步可以是通入足量Cl2 |
| D、在第④步反应为:Br2+SO2+2H2O=H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
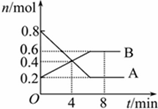 某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:
某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:查看答案和解析>>
科目:高中化学 来源: 题型:
 (g)
(g)| Pt-Sn/Al2O3 |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)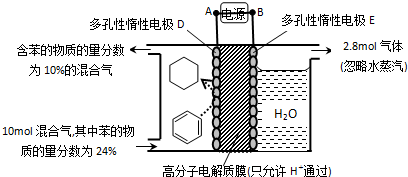
| 生成目标产物消耗的电子数 |
| 转移的电子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
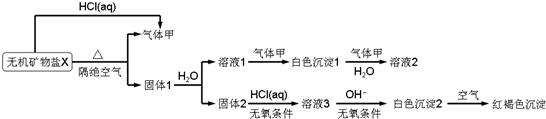
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为减缓反应速率,用饱和食盐水与电石反应制乙炔 |
| B、进行酸碱中和滴定时,锥形瓶应用待测液润洗 |
| C、实验室制乙烯时应将无水乙醇缓慢加入浓硫酸中,并加入碎瓷片以防爆沸 |
| D、配制FeCl3溶液时,向试管中加入少量Fe和稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com