
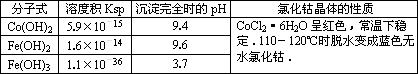
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
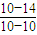 mol?L-1=10-4mol?L-1,PH=-lgc(H+)=-lg10-4=4;
mol?L-1=10-4mol?L-1,PH=-lgc(H+)=-lg10-4=4;

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
科目:高中化学 来源:广东省深圳市2011届高三二模理综化学试题 题型:022
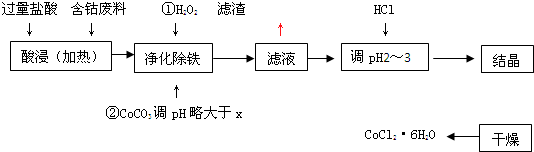
有关钴和铁化合物的性质见下表
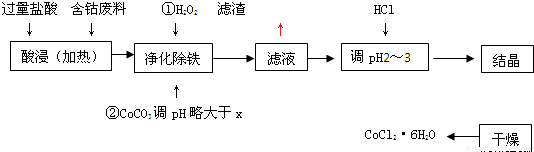
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑.工艺流程如下:
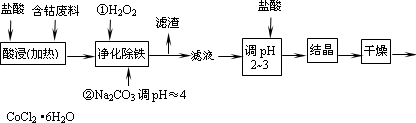
试回答:
(1)“净化除铁”中,写出加入H2O2
时反应的离子方程式________.(2)②步中用Na2CO3调pH≈4的原因是________________.
(3)“滤液”中所含主要溶质的化学式是________.
(4)为防止CoCl2·6H2O脱水,“干燥”时可采用的方法或操作是_______________.
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二上学期期末联考化学试卷(解析版) 题型:填空题
有关钴和铁化合物的性质见下表:
|
化学式 |
溶度积(室温时)Ksp |
沉淀完全时的pH |
氯化钴晶体的性质 |
|
Co(OH) 2 |
5.9×10-15 |
9.4 |
CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
|
Fe(OH) 2 |
1.6×10-14 |
9.6 |
|
|
Fe(OH) 3 |
1.0×10-35 |
x |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
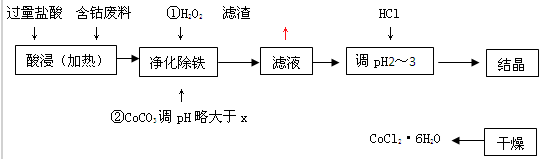
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com