
知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
A.-332 B.-118 C.+350 D.+130
科目:高中化学 来源: 题型:
用下列有关实验装置进行相应实验,错误的是( )
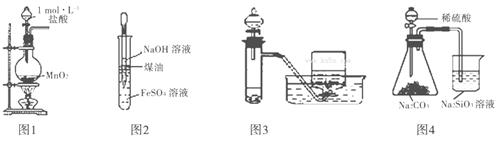
A.用图1所示装置实验室制取少量Cl2
B.用图2所示装置制取及观察Fe(OH)2
C.用图3所示装置用H2O2溶液制备O2
D.用图4所示装置比较S、C、Si的非金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质D在充足的单质E中燃烧,反应的化学方程式为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热
条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是________。
(2)组成单质B的 元素的原子结构示意图为________。
元素的原子结构示意图为________。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为________。
(4)溶液F在空气中长期放置生成H的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(5)H的溶液与稀硫酸反应产生的现象为____________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1 780 kJ/mol B.-1 220 kJ/mol
C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将盛有NH4HCO3粉末的小烧杯放入盛 有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下A与B反应可生成C和D,其能量变化如图:

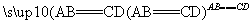

下列有关反应A+B===C+D的说法正确的是 ( )。
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
|
| A. | 向Fe2(SO4)3溶液中滴入KSCN溶液:Fe3++3SCN﹣⇌Fe(SCN)3↓ |
|
| B. | 向NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O |
|
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42﹣+Ba2++2OH﹣=2H2O+BaSO4↓ |
|
| D. | 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶
液混合反应制备ClO2气体,再用水吸收该气体可得
ClO2溶液。在此过程中需要控制适宜的温度,若温
度不当,副反应增加,影响生成ClO2气体的纯度,
且会影响ClO2的吸收率,具体情况如图所示。
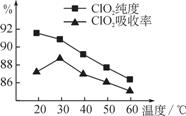
(1)据图可知,反应时需要控制的适宜温度是________℃,
要达到此要求需要采取的措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO 氧化成SO
氧化成SO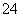 ,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式: 。
(3)该小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品
6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20mL与37.00 mL 0.500 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.0500 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:
4H++ClO2+5Fe2+===Cl-+5Fe3++2H2O
14H++Cr2O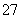 +6Fe2+===2Cr3++6Fe3++7H2O
+6Fe2+===2Cr3++6Fe3++7H2O
试计算ClO2的“产率” (写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com