
【题目】碳酸钠和碳酸氢钠都是中学常见化学药品。
Ⅰ.下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的装置:
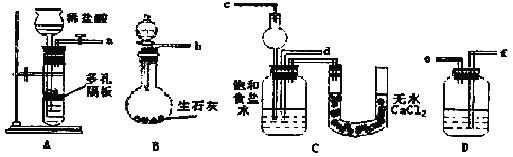
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:a接___,___接___;b接___。
(2)检查装置气密性后,必须先让___(填A或B)装置先发生反应。C中用球形干燥管而不用直导管,其作用是___。
(3)C中广口瓶内产生固体的总化学方程式为___。
Ⅱ.通过加热分解的方法可以测定碳酸钠和碳酸氢钠的含量。取13.08g碳酸钠和碳酸氢钠的混合物充分加热,将生成的CO2气体通入足量的澄清石灰水中,测得生成沉淀的质量为4.0g。
(4)加热时发生的化学反应方程式为___。
(5)原混合物中碳酸钠和碳酸氢钠的物质的量之比为___。
【答案】f e d c B 防倒吸 CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2↑ 3:4
Na2CO3+H2O+CO2↑ 3:4
【解析】
(1)足量的CO2与NaOH反应生成NaHCO3,装置A产生CO2,装置B产生NH3,装置D除去二氧化碳中的HCl,氨气通入C中应防止倒吸,则b接c,故a接f、e接d,
故答案为:f;e;d;c;
(2)侯氏制碱法是利用氨气溶解性大,极易溶解于水,二氧化碳气体水中溶解性较小,饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应让B装置先发生反应,氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管球形部分液面上升慢起缓冲作用,可以防止倒吸,
故答案为:B;防倒吸;
(3)侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,所以C中广口瓶内产生固体的总化学方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;
(4)加热时发生的化学反应方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(5)4g沉淀为CaCO3,n(CaCO3)=![]() =0.04mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.04mol,根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,碳酸钠的质量为=13.08g-6.72g=6.36g,碳酸钠物质的量=
=0.04mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.04mol,根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,碳酸钠的质量为=13.08g-6.72g=6.36g,碳酸钠物质的量=![]() =0.06mol,则原混合物中碳酸钠和碳酸氢钠的物质的量之比为0.06mol:0.08mol=3:4。
=0.06mol,则原混合物中碳酸钠和碳酸氢钠的物质的量之比为0.06mol:0.08mol=3:4。
答案为:3:4。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%。在一定条件下的以下反应中,最符合绿色化学概念的是( )
A. 用水吸收二氧化氮得到硝酸B. 铝盐溶液与氨水反应制氢氧化铝
C. 苯与液溴反应制溴苯D. 乙烯与氯化氢反应制备氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8g该有机物经燃烧生成44.0gCO2和14.4gH2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O—H键和位于分子端的—C≡C—键,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是____________________________________。
(2)下列物质中,一定条件下能与A发生反应的是________。
A.H2 B.Na C.酸性KMnO4溶液 D.Br2
(3)A的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂。用碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如图,下面说法不正确的是
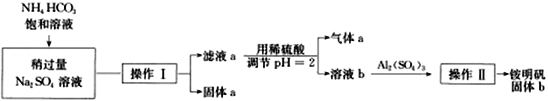
A.加入NH4HCO3饱和溶液发生反应的离子方程式:Na++HCO3-=NaHCO3↓
B.调节pH时,为了减少损耗,提高产率,可将pH试纸直接浸入滤液a中
C.操作Ⅱ的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.若过量的气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室模拟工业生产漂白粉的装置(夹持和加热装置省略)。
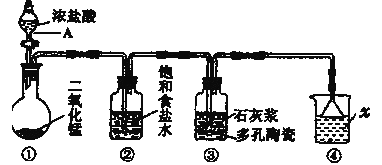
(1)写出图中仪器A的名称___;②装置中饱和食盐水的作用是___。
(2)装置①中发生反应的化学方程式为___。
(3)装置③中发生反应的化学方程式为___。
(4)装置④中发生反应的离子化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是( )
A.棕红色的NO2加压后颜色先变深后变浅
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.黄绿色的氯水光照后颜色变浅
D.合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种原子序数递增的前36号元素。X、Y是同周期元素,原子序数相差1,价电子数之和为11;Z为第三周期元素,价电子数为2;基态M原子有6个未成对电子;W属于ds区元素,有1个未成对电子。下列说法错误的是( )
A. 原子半径:Z>X>Y,电负性:Y>X>Z
B. X和Y的简单氢化物分子间均存在氢键,二者均可以作为配合物中的配体
C. Z(XY3)2晶体含离子键和共价键,酸根离子的中心原子杂化方式为sp2
D. M为ⅥB族元素,Z单质和W单质晶体的配位数均为12,空间利用率均为68%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以溴代芳烃A为原料发生如图转化,下列说法中错误的是
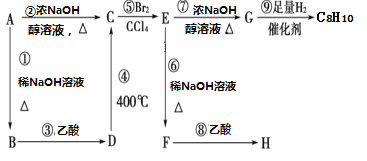
A. 合适的原料A可以有两种B. 转化中发生消去反应的是②⑦
C. C的名称为苯乙烯D. 转化中发生取代反应的是①③⑥⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com