
| 检测次数 | 溶液中检测出的溶质 |
| 第一次 | KCl K2SO4 Na2CO3 NaCl |
| 第二次 | KCl BaCl2 Na2SO4 K2CO3 |
| 第三次 | Na2SO4 KCl K2CO3 NaCl |
 、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
、CO32–和Cl–,该小组进行了如下实验,请你参与探究与分析。
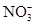 六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。
六种离子。并且甲厂的废水明显呈碱性,因此第二组断定甲厂废水中应含有的三种离子为 、 、 。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.全部为Al(OH)3沉淀 |
| B.几乎全部以[Al(OH)4]-形式存在于溶液中 |
| C.一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中 |
| D.一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2+ | B.Fe3+ | C.Al3+ | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaCO3+2H+= Ca2++CO2↑+H2O | B.2Fe2++Cl2= 2Fe3++2Cl- |
| C.HCO3-+H+= CO2+H2O | D.2Na+2H2O = 2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.能使紫色石蕊试液变蓝色 | B.能与盐酸反应生成水 |
| C.能与Na2S04溶液反应生成BaS04沉淀 | D.能与CO2反应生成水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③④ | B.①②④ | C.①②③④ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
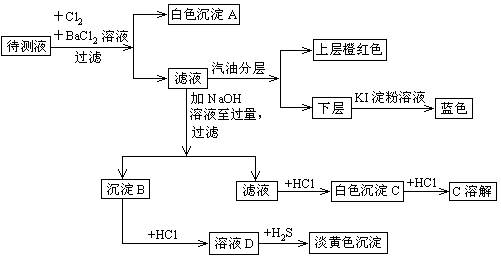
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com