
(1) ![]() 是反应性很强的正离子,是缺电子的,其电子式是:_________________。
是反应性很强的正离子,是缺电子的,其电子式是:_________________。
(2) ![]() 中4个原子是共平面的,3个键角相等,键角应是____________________。
中4个原子是共平面的,3个键角相等,键角应是____________________。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:助学丛书(化学高二·第二册) 题型:021
有些有机化学反应中有中间体生成,如碳正离子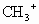 和碳自由基·
和碳自由基· 中的两种,下列关于它们的说法中正确的是
中的两种,下列关于它们的说法中正确的是
[ ]
A.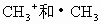 具有相同的组成,因而是相同的微粒
具有相同的组成,因而是相同的微粒
B.碳正离子和碳自由基都是共价键断裂生成的
C.碳正离子带正荷,碳自由基带负电荷
D.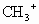 是反应性很强的正离子是缺电子的而·
是反应性很强的正离子是缺电子的而·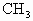 则是电中性的
则是电中性的
查看答案和解析>>
科目:高中化学 来源: 题型:021
有些有机化学反应中有中间体生成,如碳正离子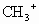 和碳自由基·
和碳自由基·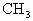 中的两种,下列关于它们的说法中正确的是
中的两种,下列关于它们的说法中正确的是
[ ]
A.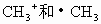 具有相同的组成,因而是相同的微粒
具有相同的组成,因而是相同的微粒
B.碳正离子和碳自由基都是共价键断裂生成的
C.碳正离子带正荷,碳自由基带负电荷
D.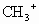 是反应性很强的正离子是缺电子的而·
是反应性很强的正离子是缺电子的而·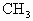 则是电中性的
则是电中性的
查看答案和解析>>
科目:高中化学 来源:2010—2011学年福建省安溪一中、养正中学高二下学期期末联考化学试卷(理) 题型:填空题
(13分)
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 molσ键和 molπ键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
查看答案和解析>>
科目:高中化学 来源:2013届福建省漳州立人学校高二下学期期中考试化学试卷(解析版) 题型:填空题
(16分)I、为减少温室效应,科学家设计反应:CO2+4H2==CH4+2H2O以减小空气中CO2。
(1)若有1mol CH4生成,则有 mol σ键和 mol π键断裂。
(2)CH4失去H—(氢负离子)形成CH+3(甲基正离子)。已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为 。
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁)。形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18。
(3)金属羰基配合物中,微粒间作用力有 (填字母代号)。
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃。由此推测,固体羰基铁更接近于 (填晶体类型)。若用Fe(CO)x表示羰基铁的化学式,则x= 。
III.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
(5)预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释。
答:HgCl42-比HgI42-更 (填“稳定”或“不稳定”),因为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com