
 完成以下实验:①用如图1所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.试回答下列问题:
完成以下实验:①用如图1所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.试回答下列问题:| △ |
| △ |
| △ |
| △ |
| △ |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:阅读理解
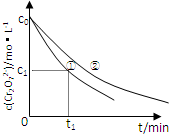 (2013?安徽)某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4?24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(2013?安徽)某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4?24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验 编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 20 |
20 20 |
| 2(c0-c1) |
| t1 |
| 2(c0-c1) |
| t1 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 反应结束 |
| 2.0mol/L硫酸 | 无明显现象 | 极少量气泡 | 少量气泡 | ||
| 4.0mol/L硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
 请回答:
请回答:| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| (1)实验①和②探究盐酸浓度对该反应速率的影响; (2)实验①和③探究温度对该反应速率的影响; (3)实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响. |
① | 25?C | 铝片 | 4.0 |
| ② | 25?C 25?C |
铝片 铝片 |
2.0 2.0 | |
| ③ | 35℃ 35℃ |
铝片 铝片 |
4.0 4.0 | |
| ④ | 25?C 25?C |
铝粉 铝粉 |
4.0 4.0 |
| 1 |
| 2 |


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
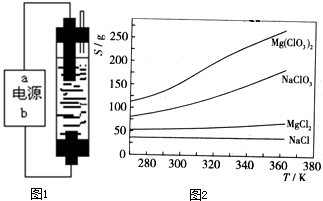
| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
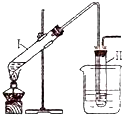 实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:| 实验步骤 | 实验操作 | 预期现象和结论 | ① | 取少量除杂后的溴乙烷于试管中, |
② | 取①中反应后的上层清液少量于另一支试管中, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com