
对于可逆反应N2(g)+3H2(g)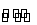 2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g) ΔH<0,下列研究目的和示意图相符的是( )
科目:高中化学 来源: 题型:
氮氧化物能造成光化学烟雾,引起大气污染,用以下方法可以消除。
Ⅰ.活性炭还原法处理氮氧化物。若向2L密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应生成甲和乙,甲和乙均为参与大气循环的物质,反应进行到不同时间测得各物质的物质的量浓度如下:
|
| NO | 甲 | 乙 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(1)该反应的化学方程式为_____________________________________________
(2)T1℃时,该反应的平衡常数K=______________
(3) 30min时改变的的条件是_______________。若30min后升高温度至T2,达到平衡时,容器中NO、甲、乙的浓度之比为2∶1∶1,则反应的△H__________0(填“<”、“=”、“>”)。
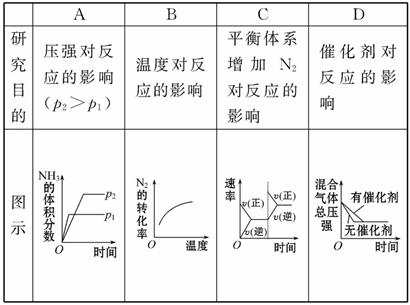
 Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
Ⅱ.以NO、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨电极Ⅰ生成NO2。
(4)石墨电极Ⅰ的反应式为______________________;为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,即必须在石墨电极Ⅱ电极处通入一种氧化物Y,Y是_______________(填物质的化学式)。
Ⅲ.CH4催化还原法。已知:
①CH4(g)+4NO2(g)  4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
4NO(g)+CO2(g)+2H2O(l) △H=-622kJ/mol
②CH4(g)+2NO2(g)  N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
③H2O(g)=H2O(l) △H=-44.0kJ/mol
(5)写出CH4(g)与NO(g)反应生成N2(g)、CO2(g)和H2O(g)的热化学方程式______________________________________________________________。
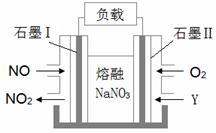
(6)假设在某温度下反应①的速率(v1)大于反应②的速率(v2)则下列反应过程能量变化示意图正确的是________(填写正确选项的字母)。
|
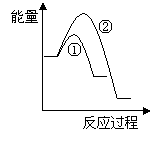
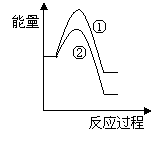
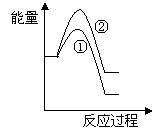


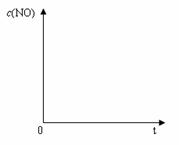
(7)恒温恒容条件下,假设反应①和②同时发生,且v1>v2,请在下图中画出反应体系中c(NO)随时间t变化的总趋势图。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
A.X与Y B.X与W C.Y与Z D.Y与W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.在标准状况下,1 mol水的体积是22.4 L
B.1 mol H2所占的体积约为22.4 L
C.在标准状况下,NA个分子所占的体积约为22.4 L
D.在标准状况下,1 mol NH3和CO混合气体所占的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用化学平衡移动原理说明的事实是( )
A.合成氨在高压下进行是有利的
B.温度过高对合成氨不利
C.使用催化剂能使合成氨速率加快
D.及时分离从合成塔中出来的混合气,有利于合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解方程式正确的是( )
A.CO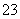 +H2O
+H2O  2OH-+H2CO3 B.NH
2OH-+H2CO3 B.NH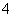 +H2O
+H2O  NH3·H2O+H+
NH3·H2O+H+
C.HCO3 ̄+H2O  CO
CO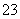 +H3O+ D.F-+H2O =HF+OH-
+H3O+ D.F-+H2O =HF+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关盐类水解的说法不正确的是( )
A.盐类水解过程破坏了纯水的电离平衡 B.盐类水解反应是酸碱中和反应的逆反应
C.盐类水解的结果使溶液不一定呈中性 D.Na2S溶液中c(Na+)是c(S2-)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
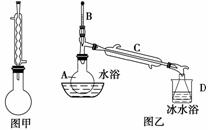
苯甲酸甲酯是一种重要的香料。其合成装置为
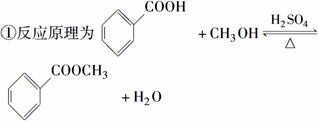
②反应物和产物的部分性质如下表所示:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 苯甲酸 | 249 | 1.265 9 | 微溶于水 |
| 甲醇 | 64.6 | 0.791 0 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.090 0 | 不溶于水 |
③实验步骤如下:
步骤一:在干燥的圆底烧瓶(如图甲)中加入12.20 g苯甲酸和12.10 mL甲醇。边缓缓摇动边加入3 mL浓硫酸,再加上几粒固体X,装上冷凝管,加热。
步骤二:取下图甲所示冷凝管,在烧瓶上安装图乙所示的装置,利用热水浴加热烧瓶;一段时间后,冷却,将烧瓶中溶液倒入分液漏斗中,先用水洗涤,再用浓碳酸钠溶液洗涤即得粗苯甲酸甲酯。
步骤三:将苯甲酸甲酯重新加入图乙所示装置中,加热,收集一定温度下的馏分,即得纯净的苯甲酸甲酯,质量为8.84 g。
回答下列问题:
(1)步骤一中固体X的作用是防止暴沸,X的名称是________________________。
(2)图甲装置中冷凝管的作用是________________________________________。
(3)图乙装置中仪器A的名称是________,仪器D的名称是________。
(4)步骤二中热水浴的目的是______________________,在分液漏斗中用水洗涤的目的是__________________,用碳酸钠洗涤的目的是______________________。
(5)步骤三中收集的馏分温度范围为________。(填正确答案标号)
a.63~66 ℃ b.197~198 ℃
c.248~250 ℃ d.>250 ℃
(6)本实验中,苯甲酸甲酯的产率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大。A元素的单质是自然界最轻的气体,E单质需保存在煤油中。A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;回答下列问题:
(1)M分子中含有 (填“极性”或“非极性”)键。
(2)D与E以1∶1形成的化合物与水反应的化学反应方程式 。
(3)A、B、C、D可形成阳离子和阴离子个数比是1∶1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1∶2加热反应,写出反应的化学方程式 ,反应生成的固体产物水溶液显碱性,原因是 (用离子方程式表示)。
(4)由N与D的单质、KOH溶液可以构成原电池,负极会产生C的单质,则其负极反应为 ;一段时间后,溶液pH (填“增大”“减小”或“不变”)。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2 L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 。该温度下的平衡常数为K= 。(保留两位有效数字)
(6)从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是
(选填序号字母)。
a.及时分离出生成物 b.平衡后再加入6 mol A物质 c.增大压强 d.使用催化剂 e.平衡后再加入2 mol C物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com