
| A. | 原子半径:C<N<O<F | B. | 最高正化合价:Si<P<S<Cl | ||
| C. | 热稳定性:GeH4<SiH4<CH4 | D. | 酸性:H3CO3<H2SiO3<Ge(OH)4 |
分析 A.同一周期中,原子序数越大,原子半径越小;
B.四种元素位于同一周期,最外层电子数逐渐增多,最高化合价逐渐增大;
C.非金属性越强,对应氢化物的稳定性越强;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.C、N、O、F位于第二周期,原子序数逐渐增大,原子半径逐渐减小,则原子半径大小为:C>N>O>F,故A错误;
B.Si、P、S、Cl位于第三周期,最外层电子数逐渐增多,最高正化合价逐渐增大,则最高化合价大小为:Si<P<S<Cl,故B正确;
C.非金属性:Ge<Si<C,则氢化物的热稳定性为:GeH4<SiH4<CH4,故C正确;
D.非金属性:Ge<Si<C,则最高价氧化物对应水合物的酸性强弱:H3CO3<H2SiO3<Ge(OH)4,故D正确;
故选A.
点评 本题考查了原子结构与元素周期律的应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握判断金属性、氢化物稳定性、最高价含氧酸的酸性强弱的方法,试题培养了学生灵活应用基础知识的能力.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
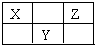 X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )
X、Y、Z三种短周期元素在周期表中的位置如图所示.若X的最高正价与负价的代数和为2,则下列说法正确是( )| A. | 原子序数由大到小为 Z>Y>X | |
| B. | 氢化物最稳定的元素为Z | |
| C. | 最高价氧化物的水化物酸性最强的元素为Z | |
| D. | 原子半径由大到小为 Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
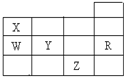 如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图所示为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A. | 元素原子半径:W<Y | |
| B. | X、Y的阴离子电子层结构都与R原子相同 | |
| C. | Y元素的非金属性比W元素的非金属性强 | |
| D. | 常温常压下五种元素的单质中,Z单质的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
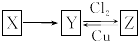 X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐酸的用量增加一倍 | B. | 盐酸的浓度增加一倍,用量减半 | ||
| C. | 温度升高30℃ | D. | 改用更小块的CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶、烧杯外还需要的其它玻璃仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com