
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L SO3含有NA个分子
B.常温常压下 4.4 g乙醛所含σ键数目为0.6 NA
C.密闭容器中2 mol NO与1 mol O2充分反应,产物分子数为2 NA
D.18 g D2O中含有的质子数为10 NA
【答案】B
【解析】
乙醛结构式为: ,其中单键都是σ键,双键中有一个σ键和一个
,其中单键都是σ键,双键中有一个σ键和一个![]() 键,所以一个乙醛分子中有6个σ键。
键,所以一个乙醛分子中有6个σ键。
A.标准状况下SO3为固态,不能根据气体摩尔体积来计算其物质的量,A错误;
B.4.4g乙醛的物质的量为![]() =0.1mol,0.1mol乙醛分子中含有σ键的物质的量为:0.1mol6=0.6mol,其数目为0.6NA,B正确;
=0.1mol,0.1mol乙醛分子中含有σ键的物质的量为:0.1mol6=0.6mol,其数目为0.6NA,B正确;
C.NO与O2反应方程式为:2NO+O2=2NO2,而NO2存在可逆反应:2NO2N2O4,导致分子数减少,所以产物分子数小于2NA,C错误;
D.重水D2O的摩尔质量为20g/mol,故18gD2O的物质的量为0.9mol,而重水中含有10个质子,所以0.9molD2O含有9NA个质子,D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.将1 mol/L NaAlO2和1.5 mol/L的HCl等体积互相均匀混合:6AlO+9H++3H2O=5Al(OH)3↓+Al3+
B.NaHCO3溶液中加入过量的Ba(OH)2溶液:2![]() +Ba2++2OH-=BaCO3↓+2H2O
+Ba2++2OH-=BaCO3↓+2H2O
C.Fe(OH)3溶于HI溶液:Fe(OH)3+3H+=Fe3++3H2O
D.在过氧化氢里加入酸性的高锰酸钾:2![]() +3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
+3H2O2 + 6H+ =2Mn2+ + 4O2↑+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物在工业生产生活中有很重要的作用。已知:实验室中可用KClO3与浓盐酸发生如下反应:
(_____)KClO 3+(_____)HCl(浓)-(_____)KCl+(_____)Cl2↑+(____) H2O,
(1)请配平该反应,并用双线桥法标出电子转移的方向和数目。______________
(2)该反应中氧化剂为______;氧化剂与还原剂的物质的量之比为______;氧化产物与还原产物的物质的量之比为______;被氧化的元素和被还原的元素的质量之比为_________。
(3)浓盐酸在反应中表现出来的性质是________________(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸
(4)当此反应中产生标准状况下13.44L的Cl2 ,则该反应转移的电子的数目为_____;被氧化的盐酸的物质的量为______mol,参加反应的盐酸的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目________,题干中反应改写成离子方程式是____。
(2)电解食盐水的过程中,被还原的元素是____________,氧化产物是______。
Ⅱ.四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________。
(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为____mol,被Fe2+还原的O2的物质的量为_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中I、II两个反应属于同一反应类型的是( )
选项 | 反应I | 反应II |
A |
| CH2=CH2→CH3CH2Cl |
B | CH3CH2Cl→CH3CH2OH | CH3CH2OH→CH3COOCH2CH3 |
C | CH3CH2OH→CH2=CH2 | CH3CH2OH→CH3CHO |
D | 油脂→甘油 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种太阳能电池的工作原理如下图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液。下列说法不正确的是
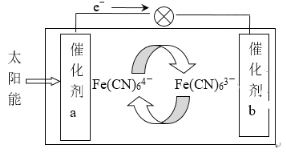
A.K+ 移向催化剂b
B.催化剂a表面发生的化学反应:Fe(CN)64--e-= Fe(CN)63-
C.Fe(CN)63- 在催化剂b表面被氧化
D.电解池溶液中的Fe(CN)64- 和Fe(CN)63- 浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以海绵铜(CuO、Cu)为原料制备氯化亚铜(CuCl)的一种工艺流程如下:

(1)Cu基态原子核外电子排布式为________,SO42 的空间构型为__________(用文字描述);Cu2+ 与OH- 反应能生成[Cu(OH)4] 2,[Cu(OH)4] 2 中提供孤电子对的原子是_______(填元素符号)。
(2)“吸收”过程:
①2NO(g) + O2(g)![]() 2NO2(g) ΔH =-112.6kJmol1提高NO平衡转化率的方法有______________(写出两种)。
2NO2(g) ΔH =-112.6kJmol1提高NO平衡转化率的方法有______________(写出两种)。
②吸收NO2的有关反应如下:
反应Ⅰ:2NO2(g) + H2O(l) = HNO3(aq) + HNO2(aq) ΔH =-116.1kJmol1
反应Ⅱ:3HNO2(aq) = HNO3(aq) + 2NO(g) + H2O(l) ΔH =-75.9kJmol1
用水吸收NO2生成HNO3和NO的热化学方程式是___________________。
(3)“电解”过程:HNO2为弱酸,通过电解使HNO3得以再生,阳极的电极反应式是____________。
(4)“沉淀”过程:产生CuCl的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于CO2和CO的有关说法正确的是
A.标准状况下,等体积的CO2与CO的质量比是7:11
B.标准状况下,等质量的CO2与CO分子数之比是11:7
C.同温同压下,等体积的CO2与CO的密度之比是11:7
D.同温同容下,等质量的CO2与CO的压强之比是11:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是重要的化工原料,在工农业生产和国防上有重要用途。
(1)实验室利用硝石(NaNO3)和浓硫酸共热制取硝酸。
①该反应利用了浓硫酸的_______性;
②该反应的温度不宜太高,原因是(用化学方程式表示)______;
(2)工业上用氨气的催化氧化法制取硝酸,再利用硝酸和氨气反应生产NH4NO3。
①写出氨气的电子式_____;
②写出氨气催化氧化的化学方程式_______;
③在生产过程中,氨催化氧化生成氮氧化物的利用率是80%,氮氧化物被吸收得到硝酸的利用率是85%,则制取80 t的NH4NO3需要氨气______t;
(3)某混合酸1L中含1mol的硝酸和2mol的硫酸。取该混合酸100mL,加入5.6g铁粉充分反应。
①反应中可以生成NO____L(标准状况);
②向反应后的溶液再加入铁粉,能继续溶解铁粉____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com