
分析 周期表前20号中的五种常见元素A、B、C、D、E原子序数依次减小,其中A是前20号元素中最活泼的金属元素,则A为K元素;且A、B、C 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应,则C为Al元素,B元素的最外层电子数为10-3-1=6,所以C为S元素;D的气态氢化物能被其最高价氧化物对应水化物吸收生成盐,所以D为N元素;E元素原子最外层电子数是次外层电子数的2倍,E有两个电子层,K层有2个电子,L层有4个电子,则电子总数为6,即E为C元素;结合元素化合物知识来解答.
解答 解:周期表前20号中的五种常见元素A、B、C、D、E原子序数依次减小,其中A是前20号元素中最活泼的金属元素,则A为K元素;且A、B、C 三种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应,则C为Al元素,B元素的最外层电子数为10-3-1=6,所以C为S元素;D的气态氢化物能被其最高价氧化物对应水化物吸收生成盐,所以D为N元素;E元素原子最外层电子数是次外层电子数的2倍,E有两个电子层,K层有2个电子,L层有4个电子,则电子总数为6,即E为C元素;
(1)由分析可知,各元素名称为:A为钾;B为硫;C为铝;D为氮;E为碳;
故答案为:钾,硫,铝,氮,碳;
(2)A、B、C 三种元素的最高价氧化物对应水化物分别为KOH、H2SO4、Al(OH)3,Al(OH)3与KOH反应生成偏铝酸钾和水,反应方程式为:Al(OH)3+KOH═KAlO2+2H2O;H2SO4与Al(OH)3反应生成硫酸铝和水,反应方程式为:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O;
故答案为:Al(OH)3+KOH═KAlO2+2H2O;2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O;
(3)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:N>C,则酸性:HNO3>H2CO3;
故答案为:HNO3>H2CO3.
点评 本题考查位置、结构及性质的应用,把握元素在周期表的位置、元素化合物知识为解答的关键,注意电子排布的应用及氢氧化铝的两性,侧重分析与推断能力的考查,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:解答题
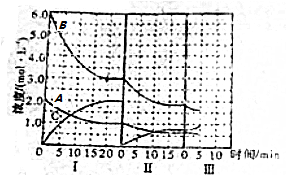
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某吸热反应能自发进行,因此该反应是熵增反应 | |
| B. | 已知NH4F水溶液中含有HF分子,因此NH4F溶液不能存放于玻璃试剂瓶中 | |
| C. | 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 | |
| D. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)=SO2(g)放出热量大于297.23kJ | |
| B. | S(g)+O2(g)=SO2(g)放出热量小于297.23kJ | |
| C. | △H=-297.23kJ•mol-1表示固体S的燃烧热 | |
| D. | 形成1molSO2化学键释放的总能量大于断裂1molS(s)和1molO2(g)化学键吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{127}$I与${\;}_{53}^{129}$I互为同位素 | |
| B. | Na+的结构示意图为 | |
| C. | 高氯酸(HClO4)中氯元素的化合价为+7 | |
| D. | I和Cl是同一主族元素,HI比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图为  | |
| B. | 质量数为37的氯原子${\;}_{17}^{37}$Cl | |
| C. | 氯化镁的电子式:Mg2+[Cl]2 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和反应是吸热反应 | |
| B. | 需要加热的反应都是吸热反应 | |
| C. | 断裂化学键要吸收能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
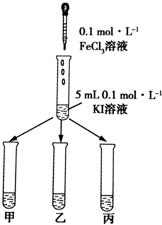 某学习小组通过下面的实验一和实验二,探究某些化学理论.
某学习小组通过下面的实验一和实验二,探究某些化学理论.| 序号 | 反应温度/℃ | C(HCl)/mol•L-1 | V(HCl)/ml | 10g碳酸钙的形状 | t/min |
| ① | 20 | 2 | 10 | 块状 | t 1 |
| ② | 20 | 4 | 10 | 块状 | t 2 |
| ③ | 20 | 2 | 10 | 粉末 | t 3 |
| ④ | 40 | 2 | 10 | 粉末 | t 4 |
| ⑤ | 40 | 4 | 10 | 粉末 | t5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com