
【题目】利用如图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法正确的是
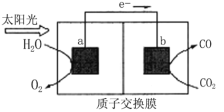
A.该装置工作时,H+从b极区向a极区移动
B.电极a表面发生还原反应
C.该过程至少涉及到3种能量的转化
D.该装置中每生成1molCO,同时生成1molO2
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_____。
(2)氨是制备氮肥、硝酸等的重要原料
①已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式_____。
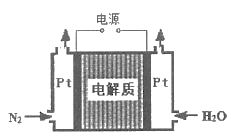
②某电解法制氨的装置如图所示,电解质只允许质子通过,试写出阴极的电极反应式_____。
(3)反应:2NO(g)+O2(g) ![]() 2NO2(g)△H<0 是制备硝酸过程中的一个反应。
2NO2(g)△H<0 是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为 2:1 置于恒温恒容密闭容器中进行上述反 应,得到NO2 体积分数与时间的关系如图所示。保持其它条件不变,t1 时再向 容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2 时再次达到平 衡,请画出 tl-t3 时间范围内 NO2 体积分数随时间的变化曲线:_________。

②在研究此反应速率与温度的关系时发现,NO 转化成 NO2 的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I.2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II.N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO 转化成 NO2 的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下 0.lmol/L 的 CH3COONH4 溶液中,c(CH3COO-):c(NH3·H2O)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是

A.气态氢化物的沸点:H2T>H2Y>H2R
B.R与Y的电子数相差8
C.非金属性:Z>Y>X
D.Z的含氧酸的酸性比Y的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,可用离子方程式![]() +2H+=CO2↑+H2O表示的是( )
+2H+=CO2↑+H2O表示的是( )
A.碳酸钙和足量盐酸的反应B.碳酸钠溶液与氯化钙溶液的反应
C.碳酸钠溶液与足量稀硝酸反应D.碳酸钡和足量硫酸的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、D、E、G、M、L六种前四周期的元素。A是宇宙中最丰富的元素。D原子核外有1个未成对电子,D+比E原子少1个电子层,E原子得1个电子填入3p轨道后,3p轨道呈全充满状态。G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G原子序数相差8。L位于周期表第12纵行且是六种元素中原子序数最大的。R是由M、L形成的化合物,其晶胞结构如下图所示。
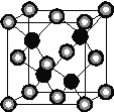
请回答下列问题:
(1)E元素的电负性________(填“>”“<”或“=”)M元素的电负性。
(2)G的第一电离能比它同周期前一族相邻元素的第一电离能________(填“大”或“小”)。
(3)M2E2广泛用于橡胶工业,在该化合物分子中,所有原子最外层均满足8电子稳定结构。则在M2E2分子中M原子的杂化类型是___,M2E2是____(填“极性”或“非极性”)分子。
(4)L的价电子排布式为________,该元素位于周期表中的________族。
(5)R的化学式为____________(用元素符号表示),属于________晶体。已知R晶体的密度为ρg·cm-3,则该晶胞的边长a________cm。(阿伏伽德常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金(含铁)空心球为吸收剂的太阳能吸热涂层,铁、镍基态原子未成对电子数各为_____________、________________。
(2)C60可用作储氢材料,已知金刚石中的C-C键的键长为0.154 nm,C60中C-C键键长为0.140~0.145 nm,有同学据此认为C60的熔点高于金刚石,你认为是否正确?_________,阐述理由:________________________________________________________________________。C60晶体(其结构模型如图)中每个C60分子周围与它距离最近且等距离的C60分子有_____个。
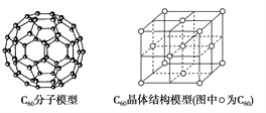
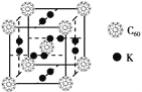
(3)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如下图所示,分子中碳原子轨道的杂化类型为_________;1 mol C60分子中σ键的数目为________。科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为________。
(4)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是______________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______个。
(5)请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:

硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是

A. 电池工作的过程中,d电极上产生气泡
B. 电池工作时,溶液中SO42-向d移动
C. c为负极,发生氧化反应
D. 电池工作的过程中,溶液中SO42-浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.硫酸氢钠与少量氢氧化钡反应:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓
C.钠与水反应:Na+2H2O=Na++2OH-+H2↑
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com