
| A. | 氢氧化镁和稀盐酸反应 | B. | Ba(OH)2溶液滴入稀硫酸中 | ||
| C. | 氢氧化钠溶液和稀硝酸反应 | D. | 二氧化碳通入澄清石灰水中 |
分析 强酸与强碱反应生成可溶性盐和水的离子反应可用H++OH-=H2O表示,据此对各选项进行判断.
解答 解:A.氢氧化镁为不溶性弱碱,离子方程式为,Mg(OH)2+2H+=Mg2++2H2O,不能用H++OH--═H2O来表示,故A错误;
B.Ba(OH)2溶液滴入稀硫酸中的离子反应为:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,不能用H++OH--═H2O来表示,故B错误;
C.氢氧化钠溶液和稀硝酸反应的离子反应为:H++OH-=H2O,故C正确;
D.二氧化碳通入澄清石灰水中,反应的离子方程式为:Ca2++CO2+2OH-=CaCO3+H2O,不能用H++OH--═H2O来表示,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高考常见题型,侧重学生思维严密性的考查,注意把握反应实质及离子反应的书写方法,题目难度不大.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容-容量瓶、胶头滴管和烧杯 | B. | 称量-天平、小烧杯和药匙 | ||
| C. | 转移-胶头滴管、烧杯和玻璃棒 | D. | 溶解-容量瓶、玻璃棒和量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| C. | 稀盐酸与碳酸钠溶液反应:2H++CO32-═H2O+CO2↑ | |
| D. | 将铁粉加入稀硫酸中:2Fe+6 H+═2Fe3++3 H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: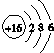 | |
| D. | 福尔马林可作食品的保鲜剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象 | |
| B. | 将8 g SO3 放入92 g水中,所得溶液溶质质量分数为8% | |
| C. | 已知H+(aq)+OH-(aq)═HO(l);△H=-57.3 kJ/mol.将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量 | |
| D. | 向100 ml 1 mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
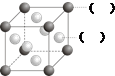 A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得.请回答下列问题:
A、B、C、D、E、F为前四周期的元素.其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法冶金”而得.请回答下列问题: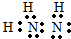 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
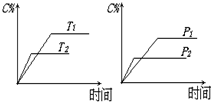 可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应mA(固)+nB(气)?e C(气)+f D(气)△H,反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,加入催化剂则C%增大 | |
| B. | 达平衡后,增加A的量有利于平衡向右移动 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后升温,则平衡向左移动,且△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com