
| A. | 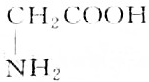 | B. | 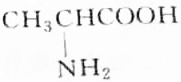 | ||
| C. | 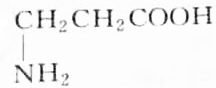 | D. | 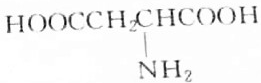 |
分析 有机物R与KOH或HCl反应时为等物质的量完全反应,说明R分子中有一个氨基(-NH2式量为16)和一个羧基(-COOH式量为45),此有机物相对分子的质量M=$\frac{4.45g}{50×1{0}^{-3}×1mol}$=89,通过式量分析:89-16-45=28,说明含有2个(CH2)或1个(CH3)和1个(CH),结合是天然蛋白质,由此分析解答.
解答 解:有机物R与KOH或HCl反应时为等物质的量完全反应,说明R分子中有一个氨基(-NH2式量为16)和一个羧基(-COOH式量为45),此有机物相对分子的质量M=$\frac{4.45g}{50×1{0}^{-3}×1mol}$=89,通过式量分析:89-16-45=28,说明含有2个(CH2)或1个(CH3)和1个(CH),对应的结构简式如B、C所示,由于天然蛋白质水解产物为a-氨基酸,故选B.
点评 本题关相对原子质量、相对分子质量的计算,有机物结构的判断等,题目难度中等,注意天然蛋白质水解产物为a-氨基酸为解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含氧酸酸性R>X | B. | 简单氢化物稳定性Y<X | ||
| C. | 最高正化合价Z<X<Y<R | D. | 由Z和R形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
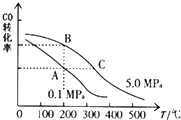 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤代烃在生产生活中具有广泛的应用,回答下列问题:
卤代烃在生产生活中具有广泛的应用,回答下列问题:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度(g/cm3) | 0.79 | 1.44 | 3.1 |
| 沸点 | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
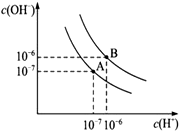 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com